摘要
多维磁共振成像(MRI)是一种多功能的微结构成像工具。我们使用具有超强梯度螺旋读数的扩散加权反演恢复自旋回波(DW-IR-SE)序列来获得丰富的扩散-松弛数据集,并对髓鞘水敏感。我们采用两步优化方法重建了一维和二维光谱,并研究了多种多维MRI方法,包括一维多分量弛豫测量、一维多分量扩散测量、二维弛豫相关成像和二维扩散-弛豫相关光谱成像(DR-CSI),以量化组织微观结构的潜力,包括髓鞘水分数(MWF)。我们在多组分T1弛豫测量、T1- t2相关、T1- d相关和T2-D相关成像中观察到一个明显的光谱峰,我们将其归因于髓磷脂水。由于与扩散测量法相比,可实现的回波时间更短,因此弛豫测量法的MWF图具有更高的质量。虽然一维多分量T1数据可以更快地绘制髓磷脂图谱,但二维方法可以提供对组织微观结构尤其是髓磷脂扩散的独特见解。
1 介绍
磁共振成像(MRI)是神经影像学中不可缺少的技术。然而,它的分辨率是有限的,关于细胞微观结构的信息,例如健康髓磷脂的数量,只能间接收集。这些信息对于检测和监测神经退行性疾病至关重要,例如多发性硬化症(MS)中的脱髓鞘。髓磷脂定位不仅可以用于此类疾病的诊断,还可以为临床医生提供目前临床常规方案(如t1加权成像、t2加权成像和液体衰减反转恢复(FLAIR))无法获得的进一步信息。虽然在这些对比图和参数图中可以看到多发性硬化症病变,髓磷脂含量还可以用于例如根据年龄区分多发性硬化症病变,或区分许多疾病中的脱髓鞘、再髓鞘形成、水肿和其他形式的神经炎症。除了可见病变外,已知在MS患者中,外观正常的白质也显示髓磷脂含量降低[36,40]。此外,定量值的使用在不同扫描方法和对象之间的比较或纵向研究中是有价值的。为此,几十年来,研究人员一直致力于通过非侵入性MRI方法定量测定中枢神经系统的髓磷脂含量[39,56]。
许多研究表明髓磷脂本身的检测结果很有希望[28,58,60],但大多数研究集中在髓磷脂层内的水的检测和所谓的髓磷脂水分数(MWF)的绘制[2,36,40]。使实验对髓鞘水信号敏感化的方法包括多指数T2衰减(多次自旋回波或GRASE) [20,22,29,39,49], T1弛豫(多次反演恢复(IR)数据或ViSTa) [33,47,54], T2制备[44,45,46]和稳态翻转角变化(mcDESPOT)[18]。
从多指数衰减中从其他水池中分离出MWF信号仍然是一个挑战。参数方法假设一个给定的生物物理模型,即给定数量的水池(通常是两个或三个)[14,15,22,34],而非参数方法获得全面的微观结构信息,而不将解决方案限制在某个模型中。为此,像T1、T2或扩散率D这样的组织参数的光谱被重建——在一个或多个维度上。早期的非参数研究主要集中在鬼怪、离体组织和木头或石头等固体中的水的核磁共振(NMR)实验上[21,26,42,53,59],而这些要求苛刻的实验尚不适用于临床MRI系统的体内研究。
最近,出现了几种正则化各种组织中这些病态逆问题的技术。Zhang和bl
虽然提到的一些多维弛豫测量和相关成像研究能够检测髓鞘水室,但其他研究却没有做到这一点。我们通过螺旋读数和高达的强梯度的组合来解决髓磷脂水的快速T2弛化的挑战,从而在扩散加权反演恢复自旋回波(DW-IR-SE)序列中实现较短的回波时间TE[43],同时通过在高级编码模型中考虑时空场动力学的重建来确保高图像质量[62]。这使我们能够获得对T1, T2,扩散或其组合敏感的丰富数据集,并研究1D多组分弛豫测量,1D多组分扩散成像,2D弛豫相关成像和2D扩散-弛豫相关光谱成像(DR-CSI)的不同1D和2D变异的潜力,用于量化大脑微观结构,特别是髓鞘水制图。
2 理论
多分量MRI假设测量的横向磁化M来自不同的室室,其特征是不同的T1、T2和扩散系数D(这里与表观扩散系数(ADC)和平均扩散系数(MD)同义)。根据已知的DW-IR-SE序列中松弛和扩散的指数方程,以及扫描参数反演时间TI、回波时间TE和b值b,分别使扫描对T1、T2和D敏感,用加权和描述r位置的信号M
(1)其中,我们用指数P对总共P组扫描参数(不同的TI, TE或b)进行编号。尽管非参数方法不假设具有一组已定义的水池的生物物理模型,但我们仍然需要离散化Eq. 1以量化隔室。假设组织参数T1, T2和D的Q个唯一组合(每个组合定义一个可能的成分),我们得到:
(2)核K的预计算
(3)的维度,其中包含所有成像和组织参数组合的指数衰减,允许将模拟信号M的前向问题表述为矩阵乘法:
(4)其中N为体素数。对于每一个体素,频谱F包含了所有Q个可能分区的信号分量。根据实验的不同,光谱可以有一个维度(如1D T1光谱)或多个维度(如2D T1- t2光谱)。因为,从给定信号估计谱F是一个病态的逆问题。
3.方法
3.1 数据采集,Reco构造和后处理
在3T Siemens MAGNETOM Skyra Connectome MR系统(Siemens Healthcare GmbH, Erlangen, Germany)上获取三名健康志愿者的体内脑数据,该系统的梯度高达1和32通道头线圈,使用带有螺旋读数的定制DW-IR-SE序列[43]。在获得书面知情同意后,所有扫描都按照当地伦理委员会的规定进行。对于每个志愿者来说,无论是TI和TE, TI和b还是TE和b都是不同的,分别导致对T1-T2, T1-D或T2-D的敏感性。所有三个数据集由不同的对比组成,即采集参数TI、TE和b的不同组合。不同的扫描协议如表1所示。使用的最大梯度强度为。此外,获取了多回波笛卡尔梯度回波参考扫描图,并用于计算线圈灵敏度和B0图。在另一项实验中,利用动态场相机(Skope Magnetic Resonance Technology AG, Zurich, Switzerland)测量了场波动[19]。
然后使用共轭梯度灵敏度编码(SENSE)重建迭代重建图像[50]。这是基于一个扩展的编码模型,使用Skope-i软件包(Skope磁共振技术股份公司,苏黎世,瑞士),考虑了测量到的三阶时空场动力学,以及线圈灵敏度和静态场不均匀性[61,62]。对复杂图像进行颅骨剥离并使用FSL FLIRT进行迭代配准[30],然后根据多指数拟合(T1-T2和T1-D)恢复信号极性。然后,对沿不同扩散方向获得的信号进行粉末平均(T1-D和T2-D数据),得到三个数据集的64种不同对比,如图1所示。最后,将完整的信号集M按体素方向归一化为L2范数,这消除了信号偏移,只留下不同TI、TE和b之间的相对差异。为了确保可比性,我们将T1-T2和T2-D数据的所有可视化分别限制为切片5和4,它们显示的大脑结构与T1-D数据大致相同(参见图1)。
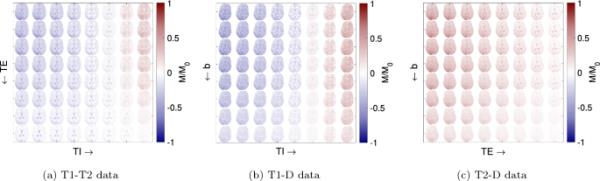
本研究中使用的所有三个二维数据集。图像显示极性校正后和归一化前的真实信号M/,使定性信号趋势可视化。粉末平均后,每个数据集包含不同的对比度,由采集参数TI, TE和b的独特组合定义。为了获得一维数据,仅使用各自2D数据集的第一行或第一列。T1-T2和T2-D分别仅显示第5片和第4片
3.2 侦察参数谱的构建
我们选择了T1, T2, d范围内的一维或二维线性间隔的光谱网格,对于光谱的重建,我们采用了Kim等人[31,32]的空间正则化和benjamin等人[6,7]的边际约束相结合的方法,分两步解决了一个凸逆问题。
在第一步中,我们将二维问题分成两个一维问题。为了求解一个参数(T1、T2或D),将编码另一个维度(TI、TE或b)的扫描参数保持在最小值(对应图1a-c中的第一行或第一列)。这为六个一维问题中的每一个留下了对比,将未知与已知的比值Q/P从2D中的3600/64降低到60/8。我们使用乘法器的交替方向法(ADMM)[9,32]来求解以下凸一维问题:
(5)第一项拟合Eq. 4中体素i的信号。第二项作为正则化器,将体素i的解与其相邻体素j的解进行比较。一维问题的空间正则化被加权,这被证明足以稳定解,同时避免过度平滑。
为了解决二维问题,我们利用Douglas-Rachford方法的推广[10,11,37,48],并继续使用减少权重的空间正则化,因为我们现在使用额外的正则化:
(6)这两个一维问题的解被认为是二维问题的边际,并作为正则化。算子将体素i的二维解投影到其各自的一维边缘,分别与对应的一维解或进行比较。对边际正则化进行加权。这使得二维解的边界接近病态程度低得多的一维问题的解,同时二维空间内的分布仍然可以多样化。最后,在整个切片上对光谱进行平均,以识别子隔室并使用阈值对其进行圈定。
3.3 信号分数与可视化
通过体素谱的阈值积分计算区隔信号分量图。髓鞘水的信号分数计算如下:
(7)对于T1-T2的情况。对于一维和二维的其他隔室或光谱,可以用类似的公式表示。在所有情况下,区隔信号分数归一化为
(8)为了与文献一致,我们使用缩写MWF,相当于。对于二维光谱和区隔信号分数图的可视化,我们使用了Crameri等人的Scientific彩色图[16,17]。
此外,频谱用于模拟预测信号的演变,遵循Eq. 4,然后通过计算均方根误差(RMSE)将其与实际数据进行比较。
目录
摘要 1 介绍 2 理论 3.方法 4 结果 5 讨论 6 结论 数据可用性 参考文献 致谢 作者信息 道德声明 相关的内容 搜索 导航 #####4 结果
图2显示了T1-T2, T1-D, T2-D及其各自的1D子集的全光谱,在整个切片上平均。我们在1D T1和2D数据中发现了三个不同的光谱区,在1D T2和1D扩散光谱中发现了两个区。我们将这些光谱成分归因于以下微观结构区室(从低到高T1/T2/D): T1, T2, D的髓鞘水,细胞内和细胞外空间(IC/EC) (T1, T2, D处的宽峰)和脑脊液(CSF)。在1D T2和1D扩散光谱中看不到MWF峰。脑脊液室非常宽,但存在于高T1/T2/D。虚线和矩形表示手动设置的定义子分区的阈值。对于二维光谱,特别是T2-D光谱,在圈定区域外存在一些杂散信号,我们将其忽略,以便进一步分析。
图3显示了从所有9个频谱中获得的所有三个子区室信号分数图。MWF地图只出现在先前划定的地方。
这五张MWF图的直方图(图4)显示,T1- t2的1D T1、T1- d的1D T1和2D T1- t2数据的髓鞘水组分相似。数据显示了两个峰值,分别归因于灰质(GM)和白质(WM)。2D T1-D和2D T2-D的数据在WM中的值也高于GM,但峰值之间的分离并不好。对直方图的高斯拟合得到以下定量值:
-
从T1到t2的1D T1: GM和WM的MWF,
-
T1- d中的1D T1: GM和WM中的MWF,其值在额叶中,也可见于图3b);
-
2D T1-T2: GM和WM的MWF;
-
2D T1-D: GM和WM的MWF;
-
2D T2-D:的MWF, GM和WM难以分离。
在CSF中,我们从T1- t2、T1- d和2D T1- t2数据中找到1D T1的MWF值。在2D T1-D和2D T2-D数据中,该算法产生了CSF的假阳性MWF。
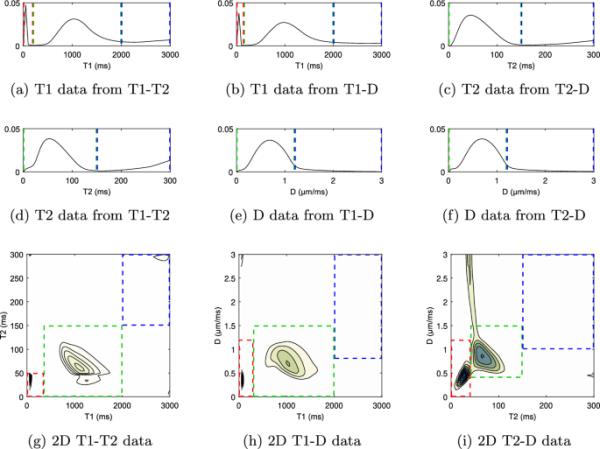
所有三个数据集的结果光谱。a-f表示我们数据的不同子集的一维光谱。g-i表示使用所有各自数据集的二维相关谱。虚线和矩形表示用于定义不同子分区的阈值。红色:快速放松,仅在a,b和g-i可见,归因于髓鞘水。绿色:中速放松,属于IC/EC。蓝色:缓慢放松,归因于脑脊液
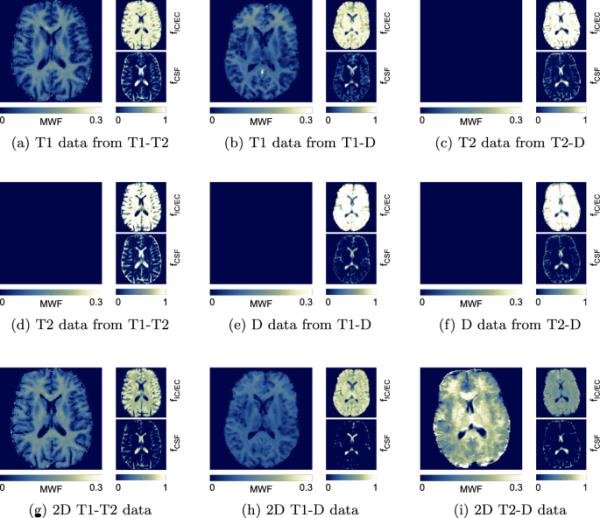
所有三个数据集的区隔信号分数谱,因为它们是由f的阈值积分产生的,a-f使用我们数据的不同1D子集,而g-i显示使用所有数据的2D解决方案。在每个亚图中,髓鞘水亚室(MWF)在左侧放大,其次是IC/EC和CSF在右侧。只有在五种方法中发现了一个独特的MWF峰,导致子图c-f中的MWF为0。请注意,我们为MWF地图选择了不同的颜色条缩放
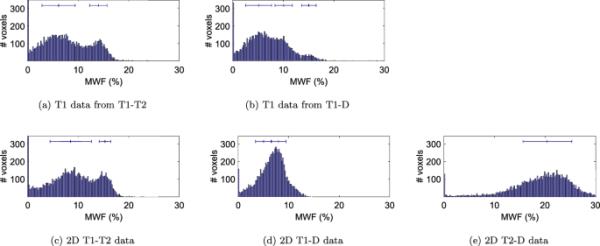
所有五种方法的MWF值的直方图,能够重建一个不同的MWF峰。直方图上方的条形图显示了拟合高斯分布的均值和标准差。在子图a-c中,可以看到两个明显的峰,这可以归因于灰质和白质。b在较高的MWF处显示了另外的第三个峰,该峰存在于额叶的WM中。在子图(d)中,GM和WM没有显示出明显的峰值,但仍然是可分离的,而在子图(e)中,我们只能对两者进行一个高斯拟合。的峰值归因于脑脊液。直方图bin宽度为
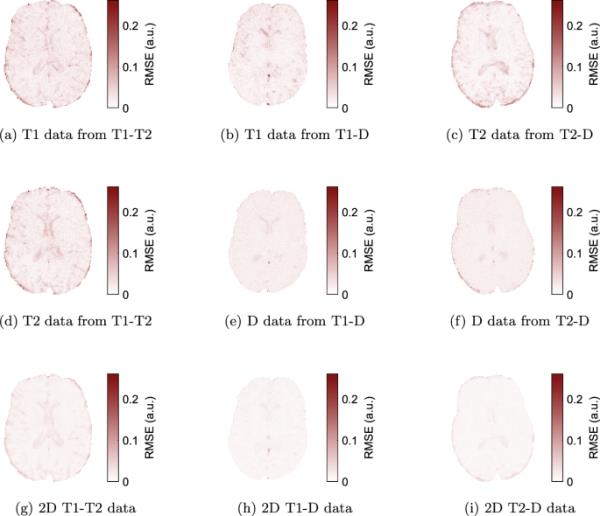
所有数据集的光谱与原始信号的拟合结果均为均方根误差(RMSE)。子图a-f为多组分一维方法,g-i为二维方法
5 讨论
我们的扫描方案是为大脑微观结构定量设计的,重点是髓鞘水。使用螺旋读数和高至的强扩散梯度,我们获得了不加扩散加权和高至扩散加权的最小TE(参见表1)。虽然这些梯度不是临床标准,但T1-T2数据不依赖于它们,也可以在临床系统上获得。由于扫描时间有限,为了在较低的值下获得足够精细的光谱网格,我们没有包括任何,并选择以最大T2重建光谱。因此,在CSF中估计T2的能力受到限制,如误差图所示(图5)。
在所有光谱中都发现了两个室室,可以归因于细胞内和细胞外空间(IC/EC)和CSF(图2)。第三个,快速放松室在9个切片平均光谱中的5个中被发现。这个隔室被确定为髓鞘水。从1D T1数据(T1- t2数据的子集)和2D T1- t2数据得到的MWF图(图3)显示出高质量,具有良好的WM-GM对比度。T1数据的MWF (T1- d数据的子集)具有较差的WM-GM对比度和整个额叶的难以置信的MWF增加。虽然表现出良好的图像质量,但从2D T1-D数据获得的MWF图显示出最低的值,并且具有较差的WM-GM对比度。对于2D T2-D数据,MWF地图质量不理想,MWF值最高,WM-GM对比度较低。
定量MWF在GM和WM附近达到峰值,不包括T2-D数据。这些值在文献报道的大多数范围内[4,23,27,35,38,39,46,55,57,63]。然而,一些研究报告WM的数值更高[8]。除了与不同体内方法的比较外,还应通过组织学检查验证结果。虽然这超出了本研究的范围,但之前的一些研究表明,类似的方法与不同组织的离体组织学有很好的一致性[63,65]。这包括Benjamini等人的工作,它启发了我们正则化光谱重建框架的设计[7]。超过拟合高斯分布标准偏差的MWF分布宽度(图4)归因于部分体积和噪声。我们还观察到,与外部部分相比,WM结构内部的MWF略高。
周围的髓磷脂水T2留给我们的髓磷脂水信号在任何扩散数据()相比。这可能解释了扩散实验中MWF图质量较低的原因,并使在1点获得的1D T1光谱和2D T1- t2光谱的结果成为本研究中最有希望用于MWF制图的结果。这些发现证实,通过螺旋读数获得的低TE对于MWF绘图至关重要,而扩散权重可能是一个限制因素。我们在1D T2光谱中没有发现明显的髓磷脂水峰。然而,先前的研究确实实现了从1D T2弛豫测量中重建MWF图。主要的区别可能在于32次的回声次数,这些研究使用了4倍的数据量[12,13,63]。我们的工作表明,1D中的多分量T1弛豫测量可以在扫描时间的一小部分内实现与2D相关成像相当质量的MWF映射-仅使用8次反演时间。
虽然扩散加权的加入延长了回波时间,但二维扩散-弛豫相关成像有望用于髓鞘水扩散系数的测量。我们的平均扩散率的结果与先前的研究基本一致,尽管髓鞘水中存在明显的D的方向依赖性[3]。对于目前的工作,我们使用了方向扩散信息的粉末平均,因为我们的目标是比较具有相同数量信号的1D和2D方法(,)。在未来,明确使用定向扩散信息可能有利于重建,并受到正在进行的工作。此外,我们设想我们关于髓鞘水扩散的信息,结合方向信息,将对神经发育、衰老或区分脱髓鞘和再髓鞘形成等研究有用。
图5中的RMSE图一致表明,与1D多分量方法相比,2D相关成像具有优势,尽管在较高的TE和b下,2D数据部分包含更多的噪声。此外,2D方法在未来更有可能可靠地分离IC和EC隔间。
这三组不同的数据来自不同的志愿者。然而,我们选择了性别相同、年龄相近的健康志愿者(参见表1),切片定位相似,避免了不同受试者间MWF差异最突出的来源[4,27]。对更多志愿者的可重复性和临床相关性的评估有待于未来的工作。
一旦经过适当的训练,中性网络有望重建一维和二维光谱[24,25,52,63]。然而,超参数优化和训练必须对每个数据集重复,并且对于本研究中广泛的数据集比较将非常耗时。
6 结论
在我们比较1D和2D方法的工作中,我们证明了扩散-弛豫相关MRI如何能够实现体内髓磷脂水定量。为此,我们研究了一维多分量弛豫成像、一维多分量扩散成像、二维弛豫相关成像和二维扩散-弛豫相关光谱成像(DR-CSI)。
利用3T连接体MR系统上的DW-IR-SE序列,我们获得了对健康志愿者T1、T2和扩散敏感的丰富数据集。螺旋读数和超强梯度实现TE低至无扩散编码和扩散编码,同时确保基于扩展编码模型的图像重建的高图像质量。
通过两步凸优化,扩展了先前二维相关光谱的重建方法,我们成功地重建了大脑体内的一维和二维光谱。1D T1光谱和所有2D光谱(T1- t2, T1- d, T2-D)均显示出明显的髓磷脂水信号峰,从而可以在体内研究髓磷脂。与此一致的是,二维相关实验的解所描述的误差低于它们各自的一维边际。我们在T1-T2数据中获得了最好的定性结果,但鉴于弥散加权成像中类似的短TE的进展,髓磷脂相关成像在未来可能会越来越多地受益于弥散MRI的独特品质。
与之前的工作相比,通常关注T1-T2相关性,我们在2D相关实验中包含扩散编码的方法,并为病态反演问题的鲁棒解开发一致的框架,将在未来使髓磷脂的研究更加详细。
下载原文档:https://link.springer.com/content/pdf/10.1007/s00723-023-01584-1.pdf

