摘要
蒸汽蒸馏法提取肉桂叶精油耗时耗力。此外,较低的收率和较高的产品降解率是这种方法的主要缺点。因此,本研究的目的是利用响应面法优化肉桂叶精油的提取工艺参数,以最大限度地提高肉桂叶精油的收率,同时保证肉桂叶精油的质量。本研究的另一个目的是将提取的精油应用于碎牛肉上,以评估其防腐效果。选取提取时间(120 ~ 210 min)、提取温度(105 ~ 115℃)和进料质量(300 ~ 600 g)为自变量,采用中心复合设计(CCD)进行优化实验。此外,还对提取的精油对肉糜的抑菌和微生物防腐活性进行了评价。在提取时间为175.43 min、提取温度为105℃、饲料质量为600 g的条件下,肉桂叶精油得率和肉桂醛浓度(%面积)的最佳预测值分别为2.9%和34.6%。二阶多项式方程与20次运行的实验数据拟合。最佳提取条件下肉桂叶精油的化学成分以丁香酚(60.68%)和肉桂醛(33.94%)为主。此外,最佳提取肉桂精油抑制细菌的生长,特别是革兰氏阳性细菌。在4℃条件下贮存21 d后,肉桂精油浓度为1.2% (v/v)的牛肉肉糜的总活菌数低于106 CFU/g。综上所述,优化后的肉桂叶精油提取工艺在保留肉桂叶精油功能特性的同时,获得了较高的得率。
介绍
精油是植物细胞质液中产生的浓缩疏水液体芳香族挥发性化合物,以小液滴的形式存在于细胞内空间[1]。对于植物来说,这些油脂的主要功能是保护其免受害虫和/或捕食者的侵害,或者促进植物间的交流[2]。为了各种用途,这些精油已经被使用了几千年。它们已被用作食品添加剂、香料和活性药物化合物。到目前为止,人们已经研究了近3000种植物的精油成分,其中有数百种已被用于商业用途[2]。
肉桂的树皮和叶子经常被用来制作各种用途的精油[3,4]。在肉桂属中有超过250种,其中C. verum是最广泛用于生产精油的物种。此外,在医药和食品添加剂中使用verum精油也是一个悠久的传统[5,6]。从verum挥发油中鉴定出124种化合物[7]。从这些化合物中,丁香酚、肉桂醛和樟脑是从肉桂植物的叶子、树皮和根皮中提取的精油中发现的主要化合物[5,8,9]。这些化合物在以往的研究中已显示出良好的抗氧化和抗微生物作用[3,10]。
芳香植物精油的提取方法既有传统的(水蒸馏、蒸汽蒸馏、溶剂萃取等),也有先进的(超临界流体萃取、微波辅助萃取、微波辅助萃取、微波蒸汽蒸馏等)[11,12]。然而,每种提取方法都有各自的优点和缺点。传统精油提取方法最著名的缺点是提取时间长(3-6 h),破坏了一些对温度敏感的化合物,同时提取了其他成分,溶剂残留大[13]。虽然先进的提取技术被认为是克服传统方法缺点的有用工具,但由于其初始投资成本高和对复杂技术的要求,它们并未广泛用于商业生产精油。因此,使用常规提取工艺生产精油的过程中,必须有保证良好工艺收率和优良质量的参数[3]。
由于初始成本和持续运营费用较低,且对环境友好,蒸汽蒸馏萃取是目前最常用的萃取技术[14]。这种提取方法仍有精油得率较低的缺点。这种低产量本质上是精油价格高企的原因。此外,蒸汽蒸馏产生的精油可能会降解主要化合物,特别是那些对温度敏感的化合物。因此,研究仍在进行中,以确定如何在不影响提取精油质量的情况下提高产量[5,15]。原料质量(植物年龄、植物部位)、前处理(日光、遮荫干燥)、颗粒大小、进料质量、工艺参数(提取时间、温度、蒸汽流量、冷却水流量等)是蒸汽蒸馏过程中需要研究、监测和优化的主要因素,以获得更高的收率和优质精油[16]。
以往的研究主要集中在肉桂精油的挥发性化合物谱[4,17]、生物活性[4,6,18]、栽培对其化学成分的影响[10]、各种提取工艺的比较[19]、肉桂精油的药用和治疗用途[20]等方面。此外,在有限自变量条件下,对肉桂精油的水蒸汽蒸馏提取工艺参数进行了优化[3,21]。据我们所知,目前还没有研究确定提取温度、时间和饲料质量如何影响肉桂叶精油的产量和质量。此外,使用这种精油作为食品防腐剂防止微生物腐败是一个悬而未决的问题,需要进一步的研究。因此,本研究的主要目的是优化影响莪术叶料中挥发油提取的关键工艺参数。此外,阐明肉桂精油浓度对牛肉肉糜微生物货架稳定性的影响是本研究的另一个目标。
材料与方法
原料收集、预处理和储存
新鲜肉桂叶(Cinnamomum verum Cin.5/82)采自埃塞俄比亚西南埃塞俄比亚人民地区Bebeka Bench Sheko(6°53′01.4′N, 35°25′41.9′E)。样品的植物学鉴定先前在Wondo-Genet农业研究中心进行,注册号为Cin. 5/82。新鲜的肉桂叶首先用自来水清洗,以清除任何灰尘和碎片的痕迹。室温(24±2℃)阴晒21 d,水分由44.42±0.03降至10.32±0.02%。最后,它被包装在聚乙烯塑料中,并在室温下保存,直到进行进一步的分析。
蒸汽蒸馏
阴凉干燥的肉桂叶首先放置在5l蒸馏生物质烧瓶中。然后,外部产生的蒸汽被喷射到两个连续排列的生物质烧瓶的底部,烧瓶的顶部保存着准备提取的样品(图1)。当蒸汽通过生物质烧瓶时,精油和水蒸气上升到冷凝器,在那里它们由气相变为液相,并回落到分离漏斗中,该分离漏斗位于冷凝器正下方。萃取时间完成后,将水从分离漏斗中抽干,将萃取油中的可见层水分离出来。然后通过无水硫酸钠过滤进一步干燥油。最后,将得到的精油保存在琥珀色玻璃瓶中,在冰箱(4°C)保存,以待进一步分析。

用蒸汽蒸馏法提取肉桂精油,实验装置包括:(1)冷凝器,(2)分离漏斗,(3)分离漏斗阀,(4)蒸汽发生器,(5)样品架生物质烧瓶,(6)注汽生物质烧瓶
然后使用式1计算提取的精油得率
(1)流程优化
采用响应面法(RSM)研究了提取时间(A)、温度(B)和进料质量(C)对肉桂醛提取率(Y1)和肉桂醛浓度(Y2)的影响。表1列出了未编码和编码级别的RSM设计。采用中心组合设计(CCD)设计试验,共设20个随机处理,包括8个分数因子点、6个轴向点和6个中心点。
挥发性化合物分析
提取肉桂精油的挥发性芳香族成分谱采用气相色谱串联质谱法(Agilent, 7890B/G7038A GC/MS System),采用[22]。简单地说,将1µL精油样品借助自动进样器喷射到GC毛细管柱(HP-5MS UI, 30 m, 0.250 mm, 0.25 μm),以氦气为载气,流速为1.0 mL/min进行分离。GC烘箱温度设定为:120℃等温3 min, 120 ~ 260℃等温10℃/min, 8 min等温。四极杆质谱仪以(1:20)的分割比运行,采集扫描范围设置为50 ~ 550 m/z,电子冲击质谱为70 eV电离能。通过与GCMS文库(NIST)和文献比较保留指数和质谱,对挥发性化合物进行最终鉴定。
总酚含量
采用分光光度法测定各提取物的总酚含量,方法如[23]所述。取提取的肉桂精油约100µL,与100µL的甲醇混合,取0.1 mL入容瓶,用0.5mL去离子水稀释。试管中加入0.2 mL提取物和0.5 mL福林试剂。Ciocalteu(用水1:10稀释)。在黑暗中保存5min后,加入1ml碳酸钠(7.5% w/v)。这些管子再次在黑暗中放置了一个小时,上面盖了一层辅助胶片。使用紫外可见分光光度计(Jasco V-530)测量765 nm处的吸收,并与没食子酸的校准曲线进行比较。构建没食子酸标准参比曲线,浓度依次为:0、20、40、60、80µg mL−1。结果以没食子酸毫克/克干燥物料为单位。
清除DPPH自由基
利用稳定自由基DPPH,测定了其抗氧化活性,测定了其供氢和清除自由基的能力。采用Blois,(1958)方法进行实验[24]。这种比色法的基本原理是,随着溶液中自由基浓度的降低,517 nm处的吸光度也随之降低。在试管中加入2 mL肉桂精油提取液甲醇原液和2 mL 1 mM DPPH溶液。然后在黑暗中放置一个小时,并在上面涂上一层薄膜。最后,用紫外可见分光光度计(Jasco V-530)测定517 nm波长处的吸光度,并与抗坏血酸的校准曲线进行比较。该试验一式三份。DPPH自由基的抑制率由式2计算。
(2)式中I = DPPH抑制率(%),A0 =对照样品的吸光度(t = 0 h), A =反应结束时被测样品的吸光度(t = 1 h)。
抗菌活性试验
采用琼脂孔扩散法测定肉桂叶精油的抑菌活性[25]。共有五种最常见的食源性细菌病原体(金黄色葡萄球菌(ATCC 25923)、单核增生李斯特菌(ATCC 1915)、大肠杆菌(ATCC 25922)、铜绿假单胞菌(ATCC 27853)、鲍曼不动杆菌(ATCC 19606))首次从埃塞俄比亚亚的斯亚贝巴的埃塞俄比亚公共卫生研究所(EPHI)获得。简单地说,每个细菌首先在营养琼脂中37℃传代培养24 h。将测试微生物的标准化接种物100µL铺在无菌Muller-Hinton琼脂上进行细菌培养。然后用无菌软木钻将琼脂切成直径为8 mm的孔,将100µL不同浓度的精油放入不同的孔中。首先在室温下孵育1小时,以确保油扩散到琼脂中,然后在37℃下孵育24小时,共3天。每次测定均为三次。正如Ashraf等人[26]所做的那样,抑制带最终以毫米为单位确定。
贮存稳定性试验
采用Burt[27]使用的方法分析牛肉碎样品的微生物货架稳定性。将50克碎牛肉与不同浓度的肉桂精油混合,制备每种处理的10个样品。处理后的样品装在无菌聚乙烯袋中,冷藏(4°C)。在时间序列分析期间,从每个处理中卫生地取10克样品,并将其加入含有90 mL 0.1%盐水的胃袋中,在25°C下彻底均质约1分钟。然后将每种样品在0.1%的盐水中进行连续稀释,并将每种稀释物的1 ml重复样品涂于平板计数琼脂(PCA)中。37℃孵育48 h后,计数总活菌数。菌落数在30 ~ 300之间时,计数总活菌数。
统计分析
采用Design Expert软件(V. 13)对实验数据进行统计评估。通过比较多个统计指标(拟合缺失、变异系数、预测和调整的相关系数),选择最佳拟合多项式模型。此外,通过计算概率为0.01、0.1和0.5的f值来确定显著差异的方差分析。
目录
摘要 介绍 材料与方法 结果与讨论 数据和材料的可用性 参考文献 致谢 作者信息 道德声明 补充信息 搜索 导航 #####结果与讨论
肉桂叶精油提取工艺的优化
蒸汽蒸馏法因其经济可行性问题而被广泛应用于从各种植物源中提取精油。然而,它在产品质量降解方面有局限性,特别是对温度敏感的活性成分。此外,使用蒸汽或水蒸馏方法从植物源中提取精油是费时和耗能的过程。基本上,如果使用蒸汽蒸馏作为提取技术,除非采用另一种减压系统,否则在较低温度下找到优质蒸汽是非常具有挑战性的。因此,在常规蒸汽蒸馏过程中,进一步降低温度几乎是不可能的。然而,通过减少暴露时间和蒸汽与植物材料之间的接触面,可以保持可接受的精油质量。这些问题可以通过操纵提取工艺参数来部分解决。因此,在本研究中,采用RSM优化技术对独立提取参数进行调整,目的是在不影响提取精油质量的情况下获得更高的得率。然而,使用流蒸馏提取精油是一个复杂的过程,它同时应用了传热和传质单元操作。因此,利用白盒模型对这一过程进行优化和预测是一项非常复杂的任务。相反,尽管有其局限性,但选择和优化有影响的工艺参数,以最大限度地提高精油的收率和质量,是一种具有成本效益的替代手段[28]。它是一种通过确定自变量集与响应之间的关系来研究和优化多变量系统的数学和统计技术。提取时间、温度和进料量是本研究中优化的自变量,以最大限度地提高产量和质量。这些参数对水蒸气和水蒸气蒸馏萃取过程的上述响应均有显著影响。特别是,增加提取时间和温度可以提高精油的得率[29]。肉桂醛和丁香酚是所有肉桂叶提取物中的主要化合物。然而,在本研究中,丁香酚的相对浓度在所有处理样品中几乎相似。因此,肉桂醛用于比较提取的肉桂叶精油的质量。自变量对响应(实验值和预测值)的影响见表2。
独立参数对精油得率的影响
考虑其他变量,各自变量对肉桂叶精油提取率的影响均显著(P < 0.001)。作为自变量之一,提取时间对肉桂叶精油收率在线性和二次水平上都有显著影响(表3)。这可以用传质的增加来解释,随着提取时间的增加,传质将使系统接近平衡。同样,提取温度的线性和二次水平对精油得率均有显著影响。这可能是因为提取温度有利于破坏植物结构释放精油,从而提高了提取过程中精油的扩散速度[30]。饲料质量对提取率也有显著的线性和二次影响(表3)。
肉桂精油产率的预测响应用二阶多项式回归方程以编码值表示(Eq. 3):
(3)式中:A为提取时间温度,B为提取温度,C为进料质量。
方差统计分析(ANOVA)表明,二次多项式模型最能代表实验数据,肉桂精油得率的决定系数(R2)值为0.9809(表3),该R2值接近于1,表明我们的二次多项式模型能很好地描述系统。采用方差分析(ANOVA)计算表3所示的二次多项式模型系数的显著性水平。
为了更好地显示自变量对肉桂叶精油提取率的交互作用,我们采用三维图,其中一个自变量保持不变,另外两个变量变化(图2)。当输入质量适中(300 g)时,增加提取时间可以提高提取率。这种积极的影响可能是由于创造了一种环境,导致溶剂和溶质之间的接触时间增加。即使在较短的提取时间(120分钟)下,生物量的增加也是如此。时间和生物质饲料的结合产生了高的精油收率(图2)。然而,较长的提取时间和较高的饲料质量的结合观察到精油收率略有下降。这可能是由于较高的进料质量引起的传质阻力增加。同样,在低温(105°C)下,增加提取时间可以提高提取率。较高的萃取温度,较短的萃取时间导致精油产量增加(120分钟)。这可能是由于较高的提取温度对植物细胞造成了更大的破坏。时间和温度的共同增加均显示出较高的精油收率。然而,较长的提取时间和较高的提取温度对肉桂精油得率的影响较小(图2B)。由于含溶质蒸汽流动导致部分精油在冷凝器中损失,可以解释在较长时间和较高温度的萃取条件下精油含量相对较低的原因。饲料质量和温度的增加也导致肉桂精油产量的增加(图2C)。然而,增加饲料质量和温度导致精油收率下降。这可能是由于较高的进料质量传质阻力或较高的蒸汽温度,这可能导致挥发性物质的损失。Fakayode和Abobi[31]在优化橘子皮油脂和果胶提取的研究中也发现了类似的结果。

A料量(g)与时间(min)、B温度(℃)与时间(min)、C料量(g)与温度(℃)对肉桂精油得率(%)的交互作用响应面图;D进料质量(g)和时间(min), E温度(℃)和时间(min), F肉桂醛(%面积)的进料质量(g)和温度(℃)
摄动图用于比较在设计空间的特定点提取时间、温度和进料质量的影响(图3A)。该图特别用于通过在其范围内仅改变一个自变量而保持所有其他变量不变来演示肉桂精油的产量。Design-Expert默认将参考值设置在所有自变量的中点(即165分钟,110℃,450 g)。随着萃取时间、萃取温度和进料质量的增加,萃取率也随之增加,反之亦然。特别是饲料质量,当它远离中心时,精油产量的增加和减少幅度更大(图3A)。这可能与萃取体系中的溶质浓度直接相关。
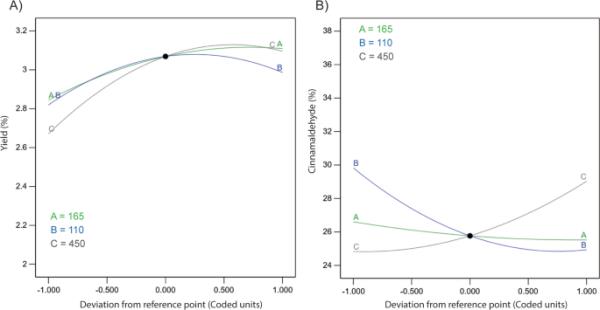
摄动图显示了自变量从最大值到最小值对A产率(%)和B肉桂醛(%面积)的变化效应
独立参数对精油品质的影响
肉桂叶精油中的两种主要化合物是丁香酚和肉桂醛[8]。这两个关键成分负责精油的独特香气和风味,以及其独特的治疗特性。由于丁香酚在所有样品中的浓度都很高且恒定,因此在本研究中使用肉桂醛来优化肉桂精油的质量。提取温度和饲料质量对肉桂醛相对浓度在线性和二次曲线上均有显著影响(P < 0.001)。虽然提取时间在线性水平上对精油品质有显著影响(P < 0.05),但在二次水平上对精油品质的影响不显著(P > 0.05)(表3)。
肉桂醛相对浓度对肉桂精油得率的影响可通过以下二阶多项式回归方程以编码值进行预测(Eq. 4):
(4)式中:A为提取时间温度,B为提取温度,C为进料质量。
利用三维曲面图展示了自变量对肉桂醛相对浓度的交互作用(图2)。提取时间自变量与提取温度或进料质量的交互作用较弱(图2D, E)。因此,时间对肉桂精油(肉桂醛)质量的影响不显著,至少在本研究指定的时间段内是如此。这可能是由于肉桂醛成分的挥发性,导致其在过程的早期阶段挥发[16]。当提取周期保持不变时,增加进料质量会增加肉桂醛的相对浓度(图2D)。无论提取时间或温度如何,增加饲料质量都会导致相对肉桂醛浓度升高(图2D, F)。这可能是由于饲料质量增加导致溶质浓度的可用性增加。随着提取时间的延长,生物量越大,饲料质量的退化程度越小。当提取温度与提取时间或饲料质量配对时,也可以看到显著的交互作用(P < 0.05)(表3)。温度越高,提取时间越长,肉桂醛的相对浓度越低(图2E)。较高的萃取温度引起的热致分解可以解释肉桂醛相对浓度较低的原因。此外,提取温度对肉桂精油质量的不利影响由于饲料质量的减少而加剧(图2F)。这可能是由于高温蒸汽与较大生物质中发现的溶质之间的直接接触减少了。
为了更好地可视化每个自变量对肉桂精油质量的影响,当它离开中点时,而所有其他参数在特定参考值保持不变,使用摄动图(图3B)。肉桂醛的相对浓度从中心点(Design-expert软件指定的参考值)开始随着温度的降低而增加,反之则完全正确。同时,当饲料质量从参考点开始增加时,肉桂醛的相对浓度也随之增加,反之亦然。
自变量优化
利用设计专家软件V.13对肉桂叶精油的收率和品质进行了不同优化方案的预测。以肉桂叶精油得率和肉桂醛相对浓度为优化目标。对于各种自变量组合的最优值,产生了54种不同的数值解。从54个方案中,选择175.43 min、105℃、600 g时间、温度和进料量作为最佳工艺参数组合,其最佳效果分别为0.71。在此条件下,肉桂醛提取率为2.9%,相对浓度为34.6%。
已开发的RSM模型的验证
采用优化后的肉桂叶精油提取液,对模型预测响应值的充分性进行了检验。在最佳条件下进行提取实验。在最佳工艺条件下,肉桂醛提取率为2.9%,相对浓度为34.6%。同时,在优化的提取条件下进行验证实验,肉桂醛的提取率为0.289,相对浓度为33.94%。这一发现表明,实验响应值与预测值非常接近(表4)。
肉桂精油的化学成分及抗氧化活性
为了进一步研究肉桂精油的功能,采用蒸汽蒸馏法在最佳条件下提取肉桂精油。在进一步研究前,采用气相色谱-质谱法测定精油含量。该GC-MS研究共发现24种化合物。其中前10个化合物占总相对面积覆盖的98%以上。与其他化合物相比,丁香酚的含量最高(60.68%)。已经确定丁香酚首先在肉桂叶中产生,而树皮在生物合成过程中只占很小的一部分。这一结果实际上与之前的结果一致,丁香酚是肉桂叶精油的主要成分。肉桂醛(33.94%)是肉桂叶精油提取物中发现的第二重要成分(表5)。从五种肉桂叶中提取的精油中也观察到这两种化合物的相似优势[10]。除了这两种化合物外,其他化合物在GC-MS分析中显示出较低的相对面积覆盖率(< 2%)。除这两种化合物外,其他化合物的面积覆盖率百分比在GC-MS分析中较低(2%)。然而,重要的是要意识到精油的成分可能会根据收获时间、原产国、植物发育阶段和市场储存条件而变化[32]。
对最佳条件下提取的肉桂精油的总酚、总黄酮和DPPH自由基清除能力进行了分析。这种抗氧化活性的作用模式是通过清除ROS和RNS(活性氮物种)产生的自由基来减少体内的氧化应激。特别是酚类化合物,由于它们倾向于提供电子或氢,以及它们是稳定的自由基中间体,因此它们作为抗氧化剂而闻名。在本研究中,肉桂精油在上述抗氧化分析中显示出良好的抗氧化活性(表5)。这种良好的抗氧化活性主要来自肉桂精油的主要化合物。特别是肉桂醛在以往的实验中表现出良好的自由基清除活性[30]。同样,肉桂精油体外抗氧化活性研究也显示出良好的抗氧化活性[17,33]。
抗菌活性和最低抑菌浓度
精油是一种新型抗菌化合物的潜在来源,尤其是对某些导致食物变质的细菌。采用体外圆盘扩散法研究肉桂精油的抑菌活性。图3显示了不同浓度肉桂精油对五种选定食源性细菌的抑菌活性[金黄色葡萄球菌(ATCC 25923)、单核增生李斯特菌(ATCC 19115)、大肠杆菌(ATCC 25922)、铜绿假单胞菌(ATCC 27853)、鲍曼不动杆菌(ATCC 19606)]。选择这些细菌是基于它们在大多数埃塞俄比亚食物中的高流行率[34]以及它们的膜结构的变化,这在它们对所施用的精油的反应中起着重要作用。
鉴于肉桂精油中存在多种化学成分,阻止微生物生长的作用方法不能归因于单一机制,而可能针对细胞中的几种活动。据预测,肉桂醛的羰基会与蛋白质结合,阻止细菌氨基酸脱羧酶发挥作用。此外,由于精油及其成分是疏水的,它们可以渗透线粒体和细菌细胞膜的脂质,扰乱细胞结构,使其更具渗透性。细胞死亡是由于这种重要的细菌细胞渗漏或重要物质和离子的损失而发生的。
然而,施用精油浓度的最小抑制浓度因细菌而异,抑制区的水平也不同。无论哪种细菌家族,随着精油浓度的增加,抑制效果都在增强(图4,附加文件1:图S2)。在本研究中,对金黄色葡萄球菌的最低抑制浓度为0.2% (v/v)。而大肠杆菌的最低抑菌浓度最高(图4)。此外,本研究中所有革兰氏阴性菌的精油浓度均高于革兰氏阳性菌。这种差异很可能是由于革兰氏阴性菌的双层含膜细胞包膜的复杂性,而革兰氏阳性菌的单层膜糖蛋白或膜糖蛋白结构。此外,在0.8% (v/v)肉桂精油浓度下接种金黄色葡萄球菌的培养皿中,观察到最高的抑制区(14 mm)(图4)。这些抑制区比早期研究[35]报道的小,这些研究测试了粗肉桂精油的抗菌活性(20 mm),然而,与本研究相比,所施用的油的浓度要高得多,并且推荐的食品用量也要高得多。
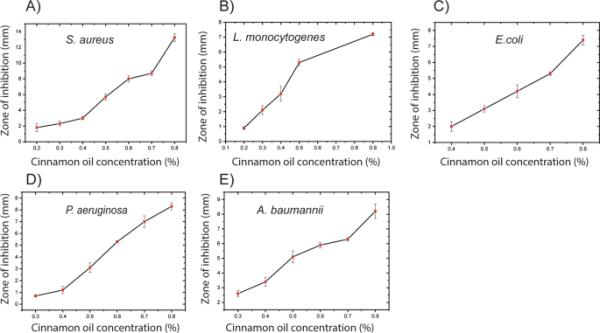
不同浓度肉桂精油对金黄色葡萄球菌、单核细胞增生杆菌、大肠杆菌、铜绿假单胞菌、鲍曼杆菌的抑菌带
精油的作用肉糜贮存稳定性的研究
当任何食品中的总活菌计数(TVC)达到7 log CFU/g时,该产品被认为是变质的[36]。图4为肉桂精油调味牛肉末和对照样品在4℃下保存21天的TVC动态。本研究中使用的生牛肉初始TVC为3.82 log CFU/g。肉桂叶精油显著降低了牛肉肉糜TVC的生长速率(P < 0.05)。更具体地说,当在碎牛肉中添加更高浓度的肉桂精油时,微生物生长下降的速度更快(图5)。
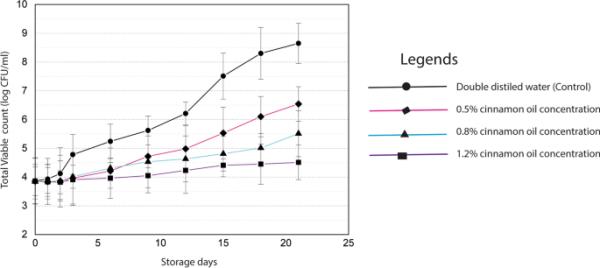
肉桂精油浓度对牛肉肉糜货架微生物稳定性的影响
然而,将精油浓度增加到1%以上可能会对食品的感官质量产生不利影响[37]。尽管如此,即使在0.5%浓度的肉桂精油处理后的样品在本调查中冷藏21天的可接受范围内。之前关于肉桂精油对食品变质微生物有效性评价的研究也得出了类似的结果[38,39]。另一方面,对照样品在储存第4天后表现出相当大的生长速度,在冷藏15天后超过了7 log CFU/g的上限(图5)。
然而,将精油浓度提高到1%以上可能会对食品的感官属性产生负面影响[37]。然而,在这项研究中,即使在0.5%的肉桂精油浓缩液中,处理过的样品在21天的冷藏中也处于可接受的范围内。以前关于肉桂对食品腐败微生物的基本有效性评价的研究也报告了类似的结果。然而,对照样品在第4天的储存后显示出显著的生长速度,在冷藏15天后超过了7 log CFU/g的最大极限(图5)。生物活性物质引起的细胞壁破裂、细胞质膜破坏、渗漏引起的细胞成分应激、脂肪酸和磷脂成分改变、影响RNA和DNA形成以及破坏蛋白质易位等几个因素,被引用作为这种抑制微生物生长的解释。
下载原文档:https://link.springer.com/content/pdf/10.1186/s13765-023-00798-y.pdf





