摘要
目前,世界范围内的女性仍然患有各种高发的女性常见病,如卵巢癌、子宫肌瘤、先兆子痫(PE)等,有些疾病甚至死亡率很高。G-protein signaling (RGS)蛋白家族作为G蛋白偶联受体信号(GPCR)的负反馈调节因子,通过G鸟苷三磷酸(GTP)水解转化,破坏酶-底物复合物的稳定,参与调节多种细胞生物学功能。近期研究表明,g蛋白信号传导调控因子2 (regulatory of G-protein Signaling 2, RGS2)作为RGS蛋白家族的一员,与某些女性疾病的发生和发展密切相关,证明了RGS2在维持女性健康方面的作用。本文就RGS2在女性常见病中的作用进行综述,并从多种机制挖掘和探讨其治疗潜力。
背景
G蛋白信号调节因子(Regulator of G Protein Signaling, RGS)蛋白家族是GPCR信号的反馈调节因子,作为G蛋白的通用GTPase激活蛋白(GAP),通常起到增加Gα-亚基天然鸟苷三磷酸酶(GTPase)活性的作用。一般来说,RGS蛋白通过增强Gα-亚基的GTP酶活性,促进GTP水解为鸟苷二磷酸(guosine diphosphate, GDP),从而使Gα亚基进入失活状态,降低其信号传导能力[1]。RGS蛋白家族大致可分为两个亚群:(1)一类主要由经典RGS结构域组成,在氨基端(n端)和羧基端(c端)均有小扩展;(2)除RGS域外,还拥有其他几个域的一类。
迄今为止,至少有37种不同的RGS蛋白已被成功发现和定义,另外14种RGS蛋白含有被命名为非功能性RGS同源结构域的结构域[2],而具有功能性RGS结构域的RGS蛋白至少可分为8个亚家族[2]。如图1所示,RGS蛋白的分类系统有两种,其中一种分类系统根据字母A到字母F对亚家族进行分类,另一种分类系统的亚家族名称来源于典型的RGS成员[3,4]。例如,RZ家族由典型的RGSZ蛋白命名[3,5]。根据氨基酸(AA)序列的身份、结构和功能,对各科进行分组。例如,属于C/R7家族的成员拥有一个特殊的Disheveled, EGL-10, Pleckstrin (DEP)结构域,称为R7H结构域,而a /RZ RGS蛋白和B/R4 RGS蛋白只拥有一个功能性的RGS结构域。RGS2作为R4家族成员,具有最简单的AA序列结构[6]。rgs2样蛋白,包括RGS1、RGS4、RGS5、RGS10、RGS13、RGS16、RGS18和RGS-GAIP,属于小亚家族,对Gα-GDP复合物亲和力很小或几乎没有亲和力。相反,这些蛋白与g α-亚基复合物的结合表现出高亲和力,特别是与AlF4和GDP的结合,导致g α-亚基的构象具有导致GTP水解的中间条件。在大鼠和人类中,RGS2基因位点位于1号染色体上,由5个外显子组成。RGS2位点编码一个212个残基的蛋白,包含一个120 AA的RGS结构域,其两侧是一个80个残基的n端结构域和一个短长度的c端尾部[7],与B/R4类其他RGS蛋白相似[6]。值得注意的是,RGS2蛋白具有内在的GAP活性,在体外对gq类g α-亚基具有强烈的选择性,而其他B/ r4家族RGS蛋白与RGS2相反,对Gi/o类和gq类g α-亚基都具有内在的GAP活性[8,9]。
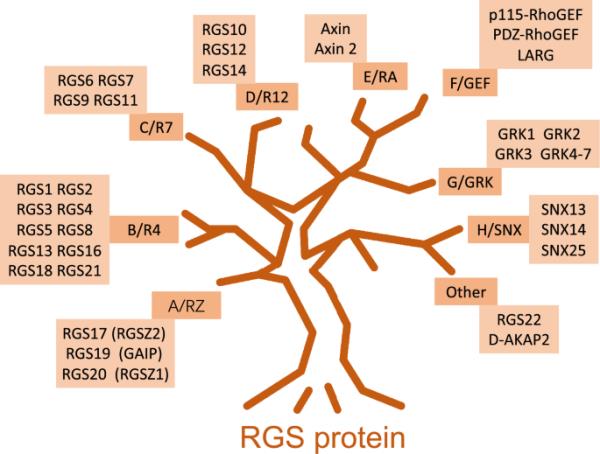
RGS蛋白家族分类简论。RGS蛋白根据序列同源性分为至少8个亚类,有或没有功能的RGS同源结构域
经典RGS结构域是g - α-亚基结合的必要条件。先前的报道显示了RGS4复合物中RGS结构域与Giα1和GDP-AlF4的晶体结构,支持了RGS蛋白如何促进GTP水解的理解[9]。RGS结构域与Giα的三个开关区结合,这些结合区在与鸟嘌呤核苷酸结合和水解时发生构象变化。结果表明,RGS结构域由9个α-螺旋进一步折叠成两个小尺寸的子结构域,其中一个子结构域形成一个右旋反平行的四螺旋束结构。此外,位于RGS结构域的三个高度保守的部分直接连接到Giα开关点,而这些部分的突变极大地干扰了RGS蛋白的GAP活性。最近,结构和生化研究的结果也表明,RGS蛋白通过降低过渡态能量刺激Gα GTP水解,导致酶底物复合物的不稳定[9]。
最近,越来越多的证据表明,RGS蛋白不仅在胚胎发育过程中发挥着重要作用,而且在多种疾病中也发挥着重要作用,包括妊娠期疾病以及妇科恶性肿瘤等妇科疾病[11,12,13],如卵巢癌和子宫肌瘤(图2)。
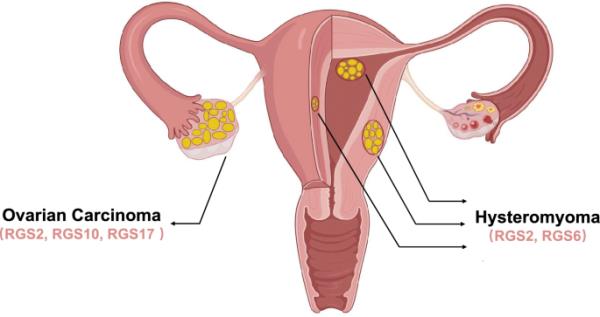
显示女性生殖系统的图表。图中,双侧卵巢组织分化明显异常,右侧卵巢组织明显肿大,卵巢组织结构异质,提示该生殖系统存在卵巢癌。子宫肌壁、粘膜下层、浆膜分别出现不同大小、不同程度的异常球形组织,提示子宫内存在子宫肌瘤
卵巢癌
卵巢癌的死亡率已超过60%,被认为是致命的妇科癌症之一[14]。人们普遍认为,早期发现有助于提高总生存率,而只有四分之一的卵巢癌在I期被发现[15]。既往研究认为,肿瘤细胞对化疗药物耐药的产生和存在以及卵巢癌在晚期的频繁诊断是卵巢癌死亡率高的主要原因[16]。与此一致的是,近期的临床数据也表明,RGS2的低表达会导致高级别浆液性卵巢癌的预后不良(图3)[17]。
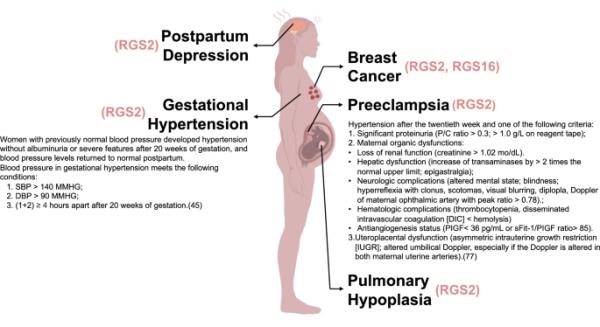
这张图表显示了女性怀孕期间的妊娠障碍。妊娠期高血压、PE、产后抑郁明显,肺发育不全、乳腺癌等相关疾病也有表现。图中的女性表现出抑郁的迹象,这可能是产后抑郁症的一种表现。乳房组织中异常的肿块结构表明患有乳腺癌。在心脏附近,对该妇女异常血压的描述表明该妇女患有妊娠高血压。异常蛋白尿和脐带的其他器质性变化表明该妇女处于PE状态。胎儿在子宫内的肺表现为异常的肺发育不良和肺纤维化的迹象
GPCRs和表皮生长因子受体(epidermal growth factor receptor, EGFRs)在卵巢癌组织中大量表达[18]。g蛋白控制gpcr介导的细胞存活信号,这与RGS蛋白的生物活性相反[19]。通过与g蛋白活化的Gα亚基直接结合,RGS蛋白可以加速GPCR信号的终止,从而促进GTP水解成GDP,使g蛋白恢复到失活状态[20,21]。因此,RGS蛋白在细胞存活和肿瘤发生中起着重要作用。RGS2的异常表达与实体瘤的发生发展有关,在卵巢癌、前列腺癌等多种癌症中RGS2表达下调[22,23,24]。然而,抑制RGS2表达的分子机制尚不清楚。因此,抑制RGS2可能通过EGFR或gpcr介导的细胞生长和细胞存活信号通路促进化疗耐药。
由于DNA甲基转移酶1 (DNMT1)和I类组蛋白去乙酰化酶(HDACs)在RGS2启动子区域的积累,卵巢癌细胞中RGS2基因的表达受到抑制。因此,这些研究结果表明,表观遗传变化,包括DNA甲基化和组蛋白修饰,如去乙酰化和乙酰化,可能导致RGS2在化疗耐药的卵巢癌细胞中缺乏表达。最近一项研究发现,RGS2的表达可通过DNA甲基化和组蛋白去乙酰化进行调节,特别是在化疗耐药的卵巢癌细胞中,RGS2的表达下降[24]。因此,可以得出一个结论,药物暴露可能导致卵巢癌变过程中RGS2表达不足[25]。此外,与化疗敏感细胞相比,化疗耐药卵巢癌细胞中RGS2启动子乙酰化组蛋白H3水平明显降低。然而,组蛋白H3在卵巢癌细胞中的表达与化疗敏感细胞相似,表明RGS2启动子乙酰化缺失导致RGS2在化疗耐药卵巢癌细胞中表达不足[25]。因此,组蛋白乙酰化可增强RGS2的表达,而hdac可拮抗RGS2的表达。另一方面,I类hdac可以抑制化学阻断卵巢癌细胞中RGS2的表达[25]。这些发现表明,化疗耐药卵巢癌细胞中HDACs(包括HDAC1-3)结合的增加与RGS2启动子组蛋白乙酰化的减少相对应。研究一致表明,I类HDAC在卵巢癌组织中丰富分布并广泛表达,而HDAC异常表达被认为与化疗不良反应密切相关[26,27]。因此,HDAC抑制剂有可能促进组蛋白乙酰化水平,从而提高RGS2表达水平,这表明抑制组蛋白去乙酰化酶活性可能成为临床治疗上皮性卵巢癌,特别是铂耐药卵巢癌的新靶点[27]。
肿瘤抑制基因甲基化的上调通常被认为是癌症进展的潜在生物标志物[28,29],DNA甲基化也被发现与卵巢癌化疗耐药有关[23,30,31,32]。DNMT1对于维持已建立的DNA甲基化模式至关重要,而DNMT3a和DNMT3b通常促进重新DNA甲基化模式的形成[33]。因此,为了在卵巢癌进展过程中维持RGS2抑制,RGS2启动子可能需要DNMT1的积累。
除RGS2外,RGS5、RGS10、RGS17等RGS蛋白也与卵巢癌密切相关[34]。在一定缺氧条件下,卵巢癌癌源性内皮细胞(ODMECs)中RGS5表达升高,靶向降低RGS5表达后,ODMECs的增殖能力显著增强。这表明RGS5在卵巢癌的致癌过程中起着关键的调节作用[35]。同样,RGS10的细胞缺乏促进卵巢癌的化疗耐药[35]。RGS10的表达受DNMT1和HDAC1的调控,RGS10的失调可降低卵巢癌细胞的化疗耐药[25,34]。RGS17可通过PI3K/AKT细胞存活通路影响卵巢癌的发生发展[36]。溶血磷脂酸(LPA)可以通过自分泌的方式与Gαi蛋白的受体结合,激活Gαi蛋白,从而磷酸化并激活蛋白激酶B (PKB,也称为AKT),从而促进细胞存活。RGS17表达升高导致LPA处理后AKT活性降低,从而说明卵巢癌细胞生长停滞的机制以及RGS17表达在卵巢癌细胞中的相关性。
综上所述,由于DNA甲基化调控是可逆的,DNA去甲基化药物可能是未来治疗癌症的有效手段,而调控RGS2、RGS10和RGS17的表达可能是增强化疗药物对耐药癌细胞活性的一种有希望的方法。
子宫肌瘤
子宫肌瘤是女性生殖器官中最常见的良性肿瘤,起源于子宫平滑肌细胞的异常增生,其中一小部分纤维结缔组织起着一种支撑“物质”的作用。在怀孕期间,由于妊娠功能的原因,子宫在前三个月会发生很大的变化。例如,与怀孕前相比,体积和重量可增加20倍之多[37]。在这些变化中,子宫肌层保持相对静止,以确保胎儿的正常发育,不响应子宫收缩。因此,由于催产素受体的表达水平相对较低,肌层对催产素的敏感性较低[38,39]。然而,调节缓动素、前列腺素、血管紧张素II、内皮素和溶血素等的GPCR水平并没有明显下降,这表明在妊娠的大部分时间,肌层并没有感知到这些药物在受体后水平的内源性浓度。部分研究表明,无法感知的原因是rgs2诱导的GTPase活性降低。由于激动剂g蛋白信号的增加和RGS2 mRNA表达的降低,妊娠末期会出现子宫禁忌症。同样,黄体酮是一种重要的黄体酮,它本身在上调RGS2 mRNA表达方面也很重要。因此,可以通过降低内源性孕酮水平延长RGS2 mRNA的表达,从而治疗子宫禁忌症。
除了上述GPCR信号在G蛋白表达水平上的调控外,受体不敏感也可能通过磷酸化G蛋白偶联受体羧基末端残基的特定激酶来表达。Brenninkmeijer等报道,人类妊娠末期子宫牵引力可能受G蛋白偶联受体激酶2和6的调控[40]。在此过程中,子宫张力收缩剂会拮抗细胞内cAMP浓度升高的作用[40]。妊娠期间,Gs在肌层的表达显著增加,产生cAMP的潜力增强[41],而Gs及其偶联腺苷酸环化酶的活性在分娩后下降[42]。尽管RGS2间接抑制GTPase活性,但有报道称RGS2直接抑制嗅觉神经元腺苷酸环化酶III活性[43]。然而,由于RGS2 mRNA水平在足月最低,这一发现本身并不能支持RGS2导致足月腺苷酸环化酶活性降低的结论。考虑到妊娠期间离散生理事件与RGS2 mRNA表达变化的关联,可以提出子宫肌层RGS2水平也参与调节子宫收缩[44]。然而,一些研究表明,子宫对收缩剂的刺激更敏感[45]。在一项研究中,当RGS2表达降低时,就会出现这种情况。因此,RGS2可能对肌层起调控作用。
综上所述,RGS2在调节子宫内膜对黄体酮的反应中起着关键作用。子宫肌瘤是一种激素依赖性肿瘤,妊娠期高激素环境是引起子宫肌瘤的重要因素之一。通过调控RGS2治疗子宫肌瘤无疑将在未来的研究进展中具有重要作用。
Gestatio部分高血压
妊娠期高血压是指妊娠前血压正常的女性在妊娠20周后至少间隔4小时出现两次收缩压≥140 mm Hg,或舒张压≥90 mm Hg,或两者同时出现(图4)[46]。高血压妇女通常不伴有蛋白尿或严重的特征,分娩后可恢复到正常的产妇血压水平[46]。妊娠期高血压的主要致病表现为全身血管痉挛和多器官灌注减少[47]。
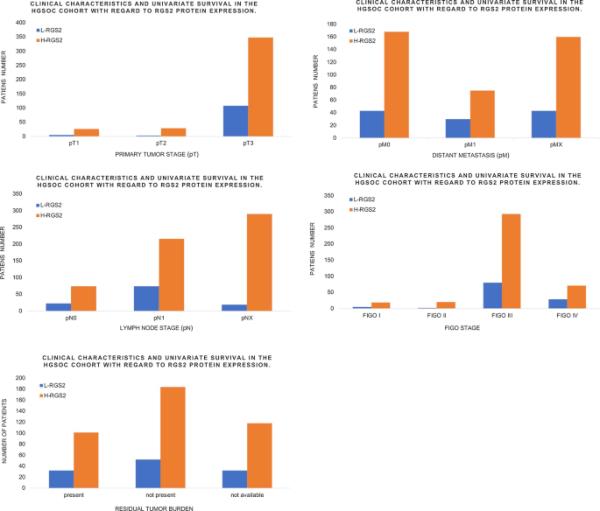
与RGS2蛋白表达有关的HGSOC队列的临床特征和单因素生存率
近年来,RGS B/R4成员的种类已被证实与妊娠血管疾病有关。在正常怀孕期间,心血管系统会发生很大的变化。心输出量显著增加,肾素-血管紧张素系统被激活,血管紧张素(ANG)在妊娠第24周分泌。此外,精氨酸抗利尿激素(AVP)分泌在同一周内同时被激活。这两种激素都能提高水的吸收率和保留率,因此,保留率可以提高到45%,从而导致渗透压降低。妊娠期血压也可降至5-10 mm Hg,且这些变化大多在妊娠6-8周早期出现[48]。妊娠期血压普遍下降,这被认为是受一氧化氮、黄体酮或松弛素的影响,而不是血管收缩激素的激活[48,49]。此外,妊娠期ANG的血管收缩反应明显降低[50]。
RGS2在人体内广泛分布和表达。除了胎盘,RGS2的高表达水平也在其他组织中被检测到,如脑、肾和心脏,最近,RGS2也在血管平滑肌细胞(VSMCs)中被发现和检测[51,52,53]。此外,Rgs2在小鼠大脑皮层、纹状体和海马等特定区域也有表达。RGS2的表达水平通过突触生物活性的激活而显著上调,并参与调节Gαq和/或g αi介导的M2毒蕈碱乙酰胆碱受体(AChR)的激活[54]。杂合子(Rgs2±)敲除小鼠和纯合子(Rgs2−/−)敲除小鼠均表现出明显的高血压表型,很难通过简单观察区分杂合子(Rgs2±)和纯合子(Rgs2−/−)[54]。此外,缺乏Rgs2 (Rgs2−/−)会导致肾动脉壁内部厚度增加,这是慢性高血压患者的一个特征[55]。Rgs2基因敲除小鼠(Rgs2−/−)与野生型小鼠(Rgs2+/+)相比,在给予血管扩张激动剂的情况下,血压下降的比例显著降低。此外,在Rgs2缺失的VSMCs中使用血管收缩剂治疗可导致钙反应峰值增加,但刺激后细胞内钙水平持续下降[55]。Rgs2缺乏还通过增加血管张力介导高血压,这一点可以通过肠系膜障碍和肾叶间动脉收缩增强以及ANG对高血压的反应升高来证明[55,56,57]。尽管RGS2主要抑制VSMCs中的g - αq信号,但在血管内皮中RGS2也可调节g - αi/o信号。g - αi/o信号通路抑制血管舒张,Rgs2缺失导致g - αi/o信号通路增强,乙酰胆碱作用下血管舒张异常[57]。此外,RGS2被证明可以调节g - αs信号。然而,RGS2不能与Gαs自身相互作用。最近,RGS2被证明可以抑制环磷酸腺苷(cAMP)的产生,特别是在Gαs的嗅膜中,因此,RGS2调节腺苷酸环化酶的活性。在多种腺苷酸环化酶中,RGS2特别能调节几种腺苷酸环化酶,包括腺苷酸环化酶III、腺苷酸环化酶V和腺苷酸环化酶VI[58]。另一方面,RGS2被发现调节avp诱导的V2受体(Gαs)介导的信号传导。在肾脏内,RGS2的表达分布仅限于表达V2受体的肾元区域,并且作为V2受体的主要信号介质,cAMP在RGS2敲除小鼠肾脏中的水平显著上调(RGS2−/−)。越来越多的证据表明,AVP[59,60,61]、内皮素-1 (ET-1)[62,63]和ANG II[62,64,65]参与了女性妊娠期高血压综合征等心血管疾病的发生和进展。参与细胞信号转导的主要受体亚型,如V1A [47, 66,67,68], V2 [69], ETA/ETB[70,71,72]和AT1受体[73,74],可分别对这些血管激素作出反应,激活靶细胞和特定组织中的G蛋白及其相应的第二信使级联反应。G蛋白信号调节因子或下游介质可能在妊娠期心血管疾病中具有普遍的共同机制,因此有望为临床治疗妊娠期心血管疾病提供更有希望的潜在靶点。
子痫前期(PE)
PE是妊娠期常见的并发症,有大量证据表明,这种情况下子宫胎盘血流量减少是由于缺氧、炎症、血管生成和抗血管生成因子失衡以及免疫紊乱的毒性组合[75,76]。此外,患有PE的女性患心血管和肾脏疾病的风险也增加[77,78]。
最近,RGS2被发现与PE有关,多项临床研究数据显示,妊娠PE患者RGS2表达失调(表1和图5)[79,80,81]。研究人员发现,在选定的人群中,位于RGS2基因3 ' -非翻译区(UTR)的单核苷酸多态性(SNP, rs4606)与PE相关[77],而同一SNP (rs4606)与PE发生风险增加密切相关,特别是在超重女性人群中[82,83,84]。此外,携带SNP (rs4606)的女性在以后的生活中患PE和心血管疾病的几率增加[85]。研究发现RGS2转录物表达水平下调与RGS2基因3 ' -UTR中的SNP相关[80]。值得注意的是,如前所述[82],Rgs2敲除小鼠(Rgs2−/−)和Rgs2杂合小鼠(Rgs2±)均表现出高血压表型,表明Rgs2基因可能出现单倍不全。此外,纯合子(Rgs2−/−)和杂合子(Rgs2±)都表现出rs4606 C1114G SNP的改变,这与人类PE发生的更高可能性有关。
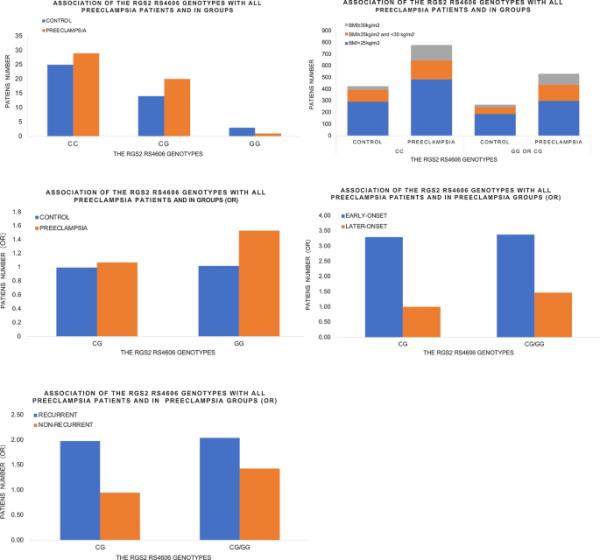
RGS2表达与所有子痫前期患者和各组的关系
妊娠引起心血管系统的生理重塑,以帮助机体在面临母体细胞外液量升高时保持正常的血压和正常的器官灌注[86,87]。在怀孕期间,血管活性激素,特别是angii水平的显著升高,能够增加外周阻力、血压、血管收缩和钠潴留。然而,这种影响通常通过上调内皮来源的放松因子的产生来抵消,主要是一氧化氮(NO)[88]。此外,由于ANG II的影响,妊娠期动脉血管变得难以收缩[89],尽管可能涉及的分子机制尚不清楚。尽管如此,这种代偿机制的缺陷可能导致女性妊娠期PE和高血压[90,91]。
RGS2在妊娠期维持血压稳定的代偿机制中具有保护作用,这可能在PE中受到阻碍。通过激活与Gq结合的AT1受体,ANG II可以触发血管收缩,增强RGS2或其他Gq调节蛋白的活性或表达,提供可能的适应性机制,通常在怀孕期间保持血压稳定。PE的病理生理学可能源于这种适应性机制的损害。最近的研究明确了G蛋白信号通路在子痫前期女性和正常妊娠女性中与血压调节相关,并证实位于3 ' -UTR的Rgs2 SNP (rs4606)与PE的进展和风险相关[79]。进一步的证据表明,携带这种RGS2 SNP并患有PE的妇女在分娩后发生高血压的可能性增加[92]。最近,我们小组的工作阐明了RGS2调节人胎盘中滋养细胞上皮-间充质转化(EMT), RGS2的失调与缺氧密切相关,缺氧导致PE[93,94]。话虽如此,为了发现妊娠期G蛋白信号是如何精确控制和功能重塑的,还需要更多的工作来回答以下问题:1)RGS2是否是这种控制机制的重要组成部分?2) RGS2能否在临床上为PE提供一个有前景的治疗靶点?
产后抑郁症
产后抑郁症(PPD)是一种常见的严重的心理健康疾病,与孕妇的痛苦有关,并对后代产生许多负面影响。产后半年被认为是抑郁症的高危期,患病率为13% ~ 19%[95]。目前对抑郁症的抗抑郁治疗和发病机制的研究主要集中在抑郁样行为表型上[96],也有研究者发现具有抑郁样行为的小鼠Rgs2表达水平较高[97]。相比之下,Rgs2的下调减轻了小鼠的认知障碍,并且sirna介导的Rgs2的下调一致地增强了海马CA1神经元中5-羟色胺(5-HT)的水平。色氨酸是5-羟色胺的来源,5-羟色胺是中枢和全身合成的[98],而5-羟色胺是产后抑郁症发病机制中公认的重要神经递质之一。此外,有报道称5-HT受体是治疗衰老认知功能障碍的潜在靶点[99],并且cAMP通路的活性在RGS2沉默后持续升高[99]。该机制可以预防抑郁行为小鼠的认知障碍,并促进海马神经元的再生[99]。因此,RGS2的沉默减少了氧化应激损伤和炎症,但增加了5-HT浓度和cAMP通路活性,从而减轻了抑郁样行为小鼠的认知功能障碍和神经元损伤。由此推测,RGS2可能在PPD的发病机制中发挥作用。然而,其机制尚不完全清楚,值得进一步研究。
乳腺癌
虽然乳腺癌不属于妇产科疾病,但它是妇女中最常诊断的危及生命的癌症之一。因此,我们在此也讨论了RGS和BC之间的潜在关系。
现在,众所周知,由于新生儿分娩后的母乳喂养,母体BC对孕妇和新生儿都有显著的影响。BC是一种可怕的女性疾病,发病率和死亡率高,严重影响女性的生活质量。先前的一项研究报道miR-183-5p可能通过调节RGS2而恶化BC的进展。此外,RGS16同属一个家族,被认为与BC有关,RGS16被认为是BC的潜在易感基因[100]。在大量BC中,研究表明RGS16位点(1q25.3)的等位基因失衡率约为50%。染色体断点主要表现为RGS16启动子区域的微缺失,并且在10%的这些肿瘤中RGS16启动子甲基化。此外,几乎三分之二(67%)的具有这种突变的肿瘤导致RGS16表达降低[101]。因此,RGS16极有可能与妊娠和分娩期间BC的发生发展密切相关,在未来具有潜在的对应价值。
表示“肺”连hypaoplasia
妊娠期间母体的妊娠障碍会导致新生儿出现肺发育不全等健康问题,已有报道发现RGS2也参与了新生儿肺的生长发育。
为了确保胎儿在分娩时在体外发育和生长良好,新生儿肺必须提供足够的体积和表面积以进行气体交换。在肺生长发育的各个阶段,胎儿呼吸运动的动态活动和肺液的积累是最重要的。RGS2抑制由gq耦合gpcr调制的持续时间和幅度等信号[102,103,104]。有趣的是,一些gq偶联的gpcr及其相应的配体在肺纤维化中被显著激活,如溶血磷脂酸受体1、蛋白酶激活受体1 (PAR1)和内皮素受体[105,106,107,108]。吡非尼酮(PFD)上调RGS2对这些信号的抑制,从而为PFD和RGS2在减少肺成纤维细胞纤维化反应方面的有用作用提供了潜在的机制论证。事实上,当凝血酶与人胎儿肺成纤维细胞1 (HFL1)细胞接触时,特发性肺纤维化(IPF)患者支气管肺泡灌洗液中的一种蛋白酶增加[109],而将RGS2的表达直接上调至与PFD治疗相当的水平,可引起人肺HFL1细胞的一系列抗纤维化反应。因此,停止PFD治疗或抑制RGS2可激活凝血酶诱导的HFL1细胞的分化和增殖,这表明HFL1细胞是IPF的关键组成部分[110]。相比之下,PFD治疗或RGS2过表达会抑制凝血素诱导的胶原生成、结缔组织生长因子(CTGF)的表达和凝胶收缩。此外,RGS2过表达可显著降低凝血酶诱导的细胞内Ca2+转运[110],而细胞内Ca2+上调可促进成纤维细胞增殖和分化,诱导成纤维细胞向肌成纤维细胞转化[111],导致II型肺细胞凋亡[112],最终导致肺纤维化的形成。综上所述,尽管相关机制尚不清楚,需要进一步研究论证,但我们自然可以推测,早产儿可能在孕妇体内缺乏RGS2的表达,从而导致妊娠期间肺发育不全的发生。
与妇女健康有关的其他疾病
RGS2作为一种重要的信号蛋白,与妇产科疾病的发生发展密切相关。除了上述疾病的研究报道(表2)外,RGS2在其他全身性疾病中也发挥着重要作用,如前列腺癌、心脏肥厚[113]等RGS2表达水平失调的疾病。此外,RGS2表达上调导致人内皮细胞系胰岛素信号传导减少,与糖尿病控制不良有关[114],这表明RGS2表达也可能与妊娠糖尿病有关,妊娠糖尿病是妊娠最常见的医学并发症之一。最近的研究也表明胃癌和结直肠癌与RGS2有关。胃癌基质中有大量RGS2沉积[115],RGS2的下调参与了结直肠癌的转移[116],表明RGS2有可能成为癌症的治疗靶点。这些腹部恶性肿瘤有可能转移并浸润女性生殖系统,从而影响女性的健康。近年来,有研究表明,RGS2的动态调控是甲状腺激素调控的潜在机制,是女性甲状腺结节病高发的主要原因[117,118],进一步证实了RGS2的表达是根据人体内特定环境严格精确控制的。因此,需要对RGS2蛋白进行持续深入的研究,通过研究和体外实验,全面了解RGS2在不同疾病中的调控功能和分子机制。
目录
摘要 背景 有限公司 结论和观点 数据和材料的可用性 缩写 参考文献 致谢 作者信息 道德声明 搜索 导航 #####有限公司结论和观点
经过几十年的努力,我们对RGS2及其在妇产科疾病中的作用有了更深入的了解。考虑到RGS2表达水平和/或功能的改变对某些疾病的影响,以及一些小的化学分子,如化合物(1-(5-氯-2-羟基苯基)-3-(4-(三氟甲基)苯基)-1 H-1,2,4-三唑-5(4 H)- 1)被动物实验证明是Gαq-RGS2信号抑制剂[119],RGS2很可能是未来治疗人类疾病的一个有希望的药物靶点。因此,确定可行的靶向RGS2的小分子药物有望有助于相关疾病的干预和治疗。
下载原文档:https://link.springer.com/content/pdf/10.1186/s12967-023-04462-3.pdf

