摘要
马绍纳鼹鼠,Fukomys darlingi (Thomas, 1895),是一种产于非洲东南部的社会性非洲鼹鼠,研究较少。在这里,我们提出了一项综合研究,描述了分配给F. darlingi的种群的遗传多样性,特别关注马拉维南部恩桑杰的动物。这些鼹鼠在体重和总体外观上与来自津巴布韦和莫桑比克的被提名的达林氏鼹鼠有明显的差异,但它们的分类地位到目前为止还不清楚。一项包含福科米属所有主要谱系的遗传分析表明,这个种群确实代表了福科米属分支中一个嵌套很深的谱系。Nsanje鼹鼠的核型也符合提名型,为2n = 54。虽然细胞核和线粒体数据都一致认为Nsanje鼹鼠属于F. darlingi,但我们的分析显示,在Fukomys系统发育树的其他分支中,线粒体核存在大量不一致。Nsanje鼹鼠明显大于命名的F. darlingi,它们的个体发育和繁殖与相似大小的同属物种非常相似,而不是命名种群。在所有非洲鼹鼠中,恩桑杰型鼹鼠的躯体生长速度是最慢的。F. darlingi的最大寿命至少为19年。所观察到的命名达林梭菌与恩桑杰鼹鼠之间的差异可能主要归因于它们的体重不同。我们的研究强调了理解非洲鼹鼠多样性的综合方法的优势,并强调了这些地下生活啮齿动物可能遇到的巨大种内变异性。
介绍
非洲鼹鼠(鼠科)是一种严格意义上的地下啮齿类动物,由于其生物学的许多特殊方面,引起了科学界的极大关注。这一类群包括6个属,分别是Cryptomys(南方普通鼹鼠)、Fukomys(北方普通鼹鼠)、Heterocephalus(裸鼹鼠)、Georychus(角鼹鼠)、Bathyergus(沙丘鼹鼠)和Heliophobius(银鼹鼠),它们主要生活在撒哈拉以南非洲的大草原栖息地。所有这些都受到了多种生理、行为和系统发育研究的影响(Begall等人,2018;Bennett & Faulkes, 2000)。然而,由于种种原因,许多分类群的生活史、物种多样性和地理分布仍然鲜为人知。考虑到一般生物学和生活史特征,我们只掌握了少数物种的相对完整的信息,如喀拉哈里沙漠的达马拉兰鼹鼠(Fukomys damarensis (Ogilby, 1838))、赞比亚安塞尔鼹鼠(Fukomys anselli (Burda et al., 1999))和非洲之角的裸鼹鼠(Heterocephalus glaber, r
在很长一段时间里,常见的鼹鼠——种类最多、分布最广的深海生物——都被归为潜鼠属(Gray, 1864;托马斯,1917;Wilson & Reeder, 2005)。分子方法显示,形态相当一致的物种,传统上由Cryptomys组成,实际上形成了两个深度分化的隐谱系,现在在属水平上分化为Cryptomys和Fukomys (Faulkes et al., 2004;Ingram et al., 2004;Kock et al., 2006)。Cryptomys和Fukomys都是社会性的,生活在合作繁殖的群体中,通常围绕一对繁殖伴侣组成。然而,尽管有证据表明,在Cryptomys中,男性生殖偏度较低,并且遗传上经常出现多夫制,但Fukomys主要是一夫一妻制(Bishop et al., 2004;Burland et al., 2002;patzenhauerov
虽然Cryptomys只在非洲南部发现,但Fukomys的分布范围从南非共和国北部到萨赫勒-苏丹北部的大草原。Fukomys是种类最多的深海属,至少有14种(Kock等人,2006;Monadjem et al., 2015)但很可能更多的物种(Faulkes & Bennett, 2013;哺乳动物多样性数据库,2022)。尽管在阐明Fukomys遗传多样性和分类方面有显著的努力(Faulkes et al., 2017;Van Daele et al., 2004, 2007, 2013),该属的许多系统发育谱系仍未得到充分研究。
在马拉维最南端的恩桑杰地区,有一个这样的福科米族世系,在奇迪迪的悬崖上尤为常见(Ansell & Dowsett, 1988)。马拉维虽然面积相对较小,但在地貌上是异质的,其富科米人的分布也不连贯。在南部的Nsanje区和北部靠近Viphya高原的Kasungu之间,没有证实的鼹鼠记录(Ansell & Dowsett, 1988)。长期以来,生活在马拉维北部的鼹鼠一直被归类为Fukomys whytei(以前的Cryptomys hottentotus whytei Thomas, 1897),它们的独特性已被遗传学研究反复证实(Ingram et al., 2004;Van Daele et al., 2007;Visser et al., 2020)。然而,并不是马拉维北部的所有富科米都属于这一物种。令人惊讶的是,Mzuzu附近的鼹鼠种群被发现在属内形成了一个非常不同的谱系(Faulkes et al., 2010)。在三种不同的系统发育中,这些Mzuzu鼹鼠与来自坦桑尼亚北部Hanang的动物拥有最近的共同祖先(Faulkes et al., 2010),后者后来被描述为一个独特的物种,F. hanangensis (Faulkes et al., 2017)。Visser等人(2020)在没有任何正当理由的情况下,将Mzuzu鼹鼠归为f.h anangensis,尽管两个谱系之间存在较长的分支长度和遗传距离。所有马拉维北部的鼹鼠通常生活在海拔1000米以上的地方。
在马拉维南部的恩桑杰地区,常见的鼹鼠出现在夏尔河沿岸的低海拔地区。它们通常被认为是与马拉维北部的鼹鼠和莫桑比克中部赞比西河以南的鼹鼠分开的(Smithers & Tello, 1976)。它们在系统发育上的亲缘关系仍不清楚。除了与F. whytei有潜在的关系外,马拉维南部鼹鼠也有可能与主要分布在津巴布韦东部和莫桑比克中部高地的马索纳鼹鼠Fukomys darlingi (Thomas, 1895)有密切关系或属于该物种(Bennett & Faulkes, 2000)。最后,这些动物可能代表了一种未被描述的物种,因为马拉维南部的鼹鼠与马拉维北部的f.w whytei和津巴布韦的f.d arlingi之间存在显著差异。特别是与命名的F. darlingi相比,马拉维南部的鼹鼠明显更大,更恒温,即在不同的环境温度下表现出更稳定的核心体温(见Bennett et al., 1994和zemanov
在这项研究中,我们使用一个线粒体和五个核基因序列来确定来自马拉维南部Nsanje地区的鼹鼠的系统发育位置。澄清Nsanje鼹鼠的分类地位很重要,因为这些动物的后代在南波希米亚大学和杜伊斯堡-埃森大学的实验室中繁殖,并用于各种行为和生理研究(见Dvořáková等人,2016;wiedenov
方法
研究动物
2005年8月,在马拉维南部Nsanje镇附近(16°55'S, 35°15'E,海拔53 m a.s.l)捕获了鼹鼠。我们总共从不同的家庭群体中获得了16只个体(5只雄性,11只雌性)(补充信息1)。其中10只个体出口到捷克共和国,成为我们在České bud<e:1> jovice的南波希米亚大学动物园内圈养种畜的后期建立者。2019年7月,该实验室血统的后代被转移到杜伊斯堡-埃森大学的动物园内。
分子数据
基于线粒体细胞色素b (CYTB)基因序列和重组激活基因1 (RAG1)、β-纤维蛋白原基因(FGB)内含子7、24-脱氢胆固醇还原酶前体(DHCR)内含子7、平滑同源前体(SMO)内含子9、瞬时受体电位阳离子通道亚家族4成员(TRPV)内含子7的5个核位点进行系统发育推断。
CYTB树包括59个序列,长706 ~ 1140个碱基对(bp)。其中,27个序列来自新鲜组织样本(GenBank数据库:OQ559424-OQ559450), 32个序列来自已发表的数据,包括3个Cryptomys作为外群(Faulkes et al., 1997,2004,2010;2017;Van Daele et al., 2007;Visser等人,2018;Krásová et al., 2021)。在分子条形码方面,从津巴布韦国家历史博物馆(NMZB)的标本中获得25个额外的短(189 bp) CYTB序列(GenBank登录:OQ559451-OQ559475)。核树是基于来自25个福科米个体的122个序列;(30个序列由uhrov
使用商业试剂盒(DNeasy Blood & tissue kit, Qiagen)按照制造商的方案从新鲜组织样本中提取DNA。核苷酸序列通过聚合酶链反应扩增,使用uhrov
cytb测序的个体几乎覆盖了Fukomys属的整个地理范围(图1),但特别关注的是来自Nsanje的种群(由2个个体代表)和来自邻近地区的鼹鼠,包括F. whytei和F. darlingi的几个假定代表。具有核序列数据的个体代表了该属所有主要CYTB谱系。所用材料的完整清单在补充信息2中提供,其中还包括已公布序列的GenBank登录号和采样点的地理坐标(如果有的话)。最后,图1和补充信息2还包含了30条F. darlingi的附加记录,其GPS坐标来自Monadjem et al.(2015)。
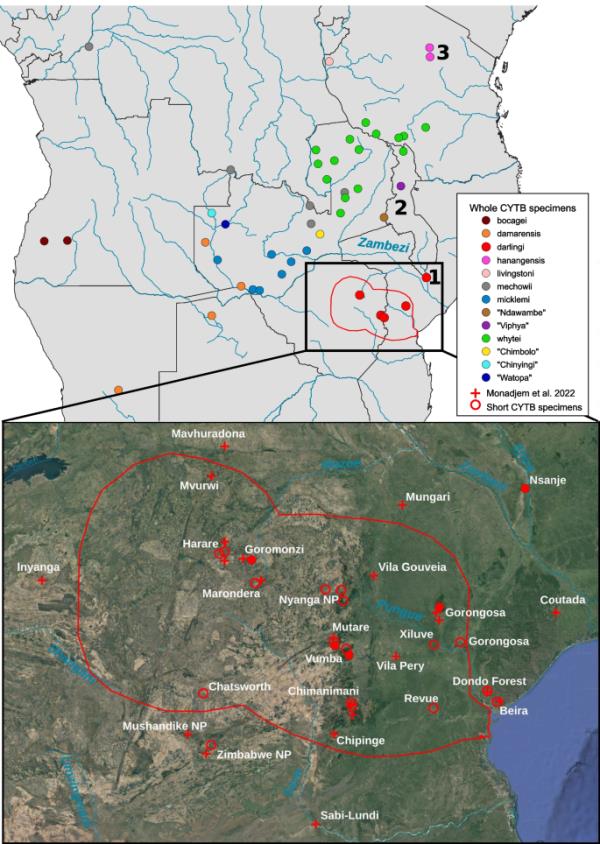
为本研究取样的鼹鼠的地理分布。在插图中,全圆表示整个CYTB序列所代表的位置,空符号表示博物馆样本的短CYTB序列。红十字会显示Monadjem et al.(2015)发表的Fukomys darlingi个体记录。符号的颜色与图4和图5所示树中所示的CYTB谱系相匹配。红色轮廓显示了根据IUCN红色名录(IUCN 2022)估计的达林芝的范围。来自加纳(Fukomys zechi: Atebubu: 7.75N, 1W)和尼日利亚(Fukomys foxi: Panyam: 9.4104411N, 9.21362 2e)的样本未被描述。1、恩桑杰+奇迪迪;2、Kasungu + Mzuzu;3, Hanang
系统的方法
CYTB树通过MrBayes 3.2.6中实现的贝叶斯推理进行重构(Ronquist et al., 2012)。采用GTR + F + G4核苷酸置换模型(tavar
CYTB谱系,代表假定的物种,使用分支切割法(http://k1.fpubli.cc/file/upload/202309/01/fmybi4rfhua)确定。其R实现可在https://github.com/onmikula/phyloeda获得。该方法根据分支的重要性将树划分为谱系,并假设物种形成是一个独特的过程,删除任何代表物种形成的分支都会显著改变给定系统发育的结构。划分受以下假设约束:先前分类为bocagei和f.m echowii的个体是异种的,谱系也要求是单系的,后验概率(PP)≥0.50。为了更好地理解假定物种之间的差异,我们计算了将它们分开的平均两两Kimura双参数(K2P)距离(Kimura, 1980)。
博物馆标本的短序列,不包括在CYTB树中,使用进化定位算法(EPA;Berger et al., 2011)在RaxML v8.2.10 (Stamatakis, 2014)中实现。简而言之,该算法尝试将查询序列一个接一个地放置在预先指定的系统发育树上,并输出一个包含潜在位置(即树分支)及其似然权重的表。我们设置EPA将每个CYTB短序列分别放在MrBayes分析的MCC树上,并为每个序列计算属于不同谱系的相对概率。概率是属于谱系的分支位置的可能性权重的总和。用于EPA输出后处理的R函数可在https://github.com/onmikula/epatools上获得。
核系统发育树的推断也在MrBayes中完成,使用所有五个位点的串联序列。与CYTB分析一样,每个基因座被设置为一个单独的分区,由ModelFinder选择其自己的核苷酸替代模型。选择的模型为DHCR和SMO的HKY + F, FGB的HKY + F + G4, RAG1的GTR + F, TRPV的GTR + F + G4 (Hasegawa et al., 1985;Tavare, 1986;杨,1994)。核序列被分析为无相,杂合状态被视为不明确。MrBayes独立运行4次,5 × 106代,每5000代采样一次。检验MCMC的收敛性,并将后验样本总结为CYTB分析。
染色体组型的f . darlingi从Nsanje
来自Nsanje种群的F. darlingi的核型是从杜伊斯堡-埃森大学保存的一只雄性鼹鼠(野生捕获的鼹鼠的F2后代)的血液样本中建立的。用植物血凝素L (PAN Biotech, 3 μg/mL)在37℃下刺激全血培养淋巴细胞进入细胞周期2天。有丝分裂细胞用80 ng/mL的水仙碱(Ciba, 80 ng/mL)阻滞。制备和吉姆萨染色按标准程序进行。检测c -中期的染色体。总共分析了12个有丝分裂细胞。
的生殖、产后发育和两性异形f . darlingi从Nsanje
在南波希米亚大学České budjouvice和杜伊斯堡-埃森大学的室内对Nsanje种群中的F. darlingi家族进行了监测。用园艺泥炭(České bud
收集了来自14个家庭的个体的生殖和产后发育数据。我们记录了产仔数和产仔间隔作为妊娠期长度的代表(c.f. Burda, 1989,1990)。对于一些幼崽,我们专门监测了它们出生后的发育情况,包括体重(每3天测量一次)、皮毛和外部可见门牙的存在、眼睛的睁开以及特定行为(吃固体、第一次离开巢穴、开始与其他家庭成员争吵)。
我们借助Rstudio (Rstudio Team, 2020)中的软件包lme4 (Bates et al., 2022)计算了以幼崽体重(g)为因变量、产仔数为固定因素、产仔数为随机因素的线性混合模型。因变量的高斯分布和模型残差的正态性均采用Shapiro-Wilk检验(p > 0.05)。
使用以下公式估算时间t的体重W和符合Gompertz生长曲线的生长参数,共73只个体(32只雄性,41只雌性)达到接近成年体重(即至少90克和/或在4周内体重没有增加):
其中A为渐近体质量(g), K为生长常数(天−1),I为拐点。最大生长率(g ×天−1)计算为K × A × e−1 (Begall, 1997)。计算生长参数的个体平均年龄为8.1±4.5岁(范围:1-16.4岁)。以家庭为随机因素,性别和育种状况为解释变量,采用广义线性回归模型对包括最大生长率在内的生长参数进行分析。
在10年(520周)的过程中,我们可视化了两种状态组(繁殖者和非繁殖者)的雄性和雌性的生长轨迹。如果收集了各自状态组中至少三个个体的体重,则根据性别和繁殖状况考虑一组的每周平均值。
目录
摘要 介绍 方法 结果 讨论 结论 数据和材料的可用性 代码的可用性 参考文献 致谢 作者信息 道德声明 补充信息 搜索 导航 #####结果
野生f . darlingi从Nsanje
野外捕获的鼹鼠颜色为深灰色,头部有较大的大小形状各异的白色斑点(见图2)。雄性比雌性大(见表1),其中一只雌性怀有3个胎儿。关于自由生活个体的形态和生殖条件的其他信息可在补充资料1中找到。

选自马拉维及邻近地区的福科鼠。图为来自坦桑尼亚南部的F. whytei代表(左上),来自津巴布韦的F. darlingi代表(右上),以及来自马拉维南部恩桑杰的F. darlingi代表(左下:捕获当天的现场;右下:České布德涅维什南波西米亚大学的被俘家庭)。照片由蒂姆·杰克逊和R. Šumbera提供
染色体组型的f . darlingi从Nsanje
Nsanje达林芝双倍体染色体数为2n = 54,有23条异/远心染色体(包括雄性的单X染色体)和31条异/远心染色体(包括雄性的单Y染色体)。基数为78,常染色体基数(aFN)为76(图3)。
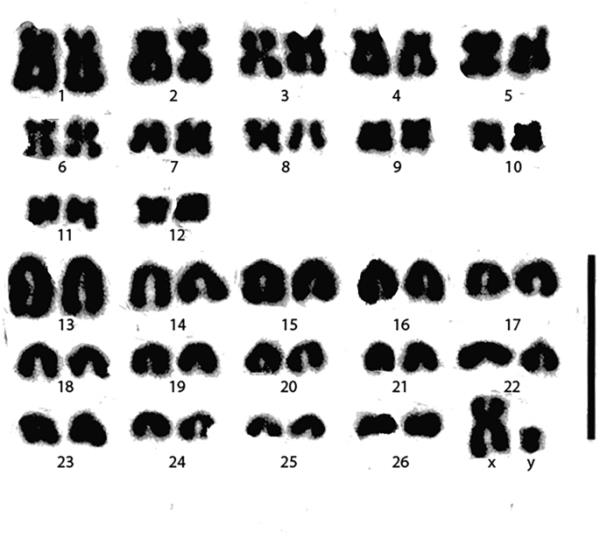
马拉维恩桑杰一头雄性狐猴的染色体核图研究2n = 54;aFN = 76。根据着丝粒的位置和染色体的大小对染色体进行排列。X染色体是被任意指定的。竖条代表10µm
的系统发育位置f . darlingi源自Nsanje和属的系统发育Fukomys
CYTB树(图4)包含15个由树枝切割方法划分的谱系,这些谱系代表了已经被认可的Fukomys物种(F. foxi, F. zechi, F. mechowii, F. bocagei, F. livingstoni, F. hanangensis, F. whytei, F. darlingi, F. damarensis和F. micklemi),以及新的推定物种(来自赞比亚中部的“Chimbolo”,来自赞比亚西部的“Chinyingi”和“Watopa”,来自赞比亚和马拉维边境的“Ndawambe”和来自马拉维北部的“Viphya”)。MCC树的拓扑结构表明,来自Nsanje的一对单倍型属于PP = 1.00的F. darlingi谱系。来自恩桑杰的鼹鼠和来自莫桑比克戈龙戈萨的鼹鼠(PP = 1.00)形成了达林芝乳杆菌的内部谱系。这符合他们的地理分布,因为戈龙戈萨是离恩桑杰最近的地方。达林氏F.与其他CYTB世系的平均K2P距离为0.0688 ~ 0.1742。达林芝家系内的平均K2P距离较低:达林芝家系整体为0.0299,恩桑杰居群为0.0029,恩桑杰居群与其他达林芝家系个体之间为0.0285。这种内部变异可与其他具有较大地理分布的谱系相比较,例如f.m icklemi(0.0179)或f.m echowii(0.0374)。对于CYTB世系之间和F. darlingi世系之间的成对距离的完整矩阵,参见补充信息3。所有博物馆样品的CYTB短序列都有非常高的概率(> 0.99)放置在F. darlingi中。这些数据,连同该地区其他鼹鼠的博物馆记录,表明该物种主要分布在津巴布韦的马绍纳兰高原和莫桑比克的低地地区,在赞比西河和萨维河之间(见图1)。
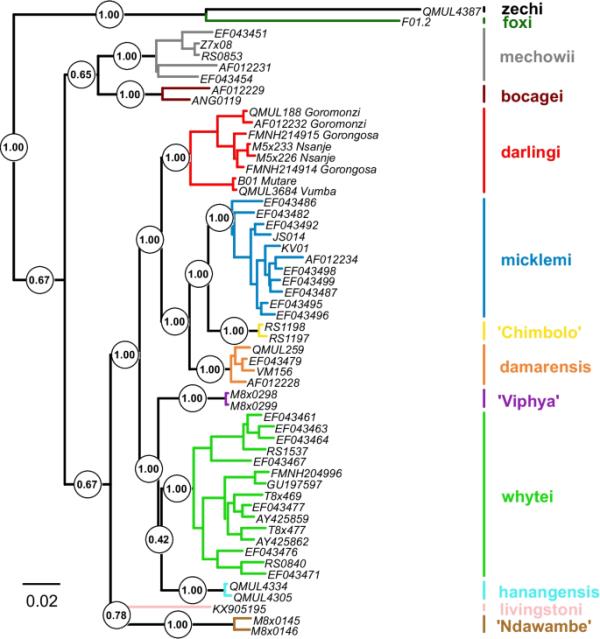
大鼠线粒体系统发育。从CYTB数据集估计MCC树,用分支切割方法划分彩色谱系。CYTB谱系的颜色与范围图和核树中显示的颜色一致(图1和图5)。尖端标签包含标本id,属于F. darlingi的标本也包含原产地
核系统发育树仅部分与CYTB相匹配(图5)。大多数CYTB谱系也在核树中发现,但其中一些是混合的,即与F. damarensis和F. micklemi鉴定的谱系。主要CYTB分支的单一性,包括damarensis-micklemi-“Chimbolo”,在很大程度上得到了核数据的支持,但它们的关系有时在树木之间有所不同。例如,darlingi谱系在两种树中都有不同的近亲:CYTB树的进化枝damarensis-micklemi-“Chimbolo”-“Chinyingi”-“Watopa”,但核系统发育的进化枝whytei-hanagensis-“Viphya”-“Ndawambe”。然而,来自恩桑杰的鼹鼠再次被恢复为高支持率的F. darlingi的一部分(PP = 1.00)。虽然它们占据了物种范围的外围,但它们属于深嵌在F. darlingi中的一个谱系(PP = 0.98)。
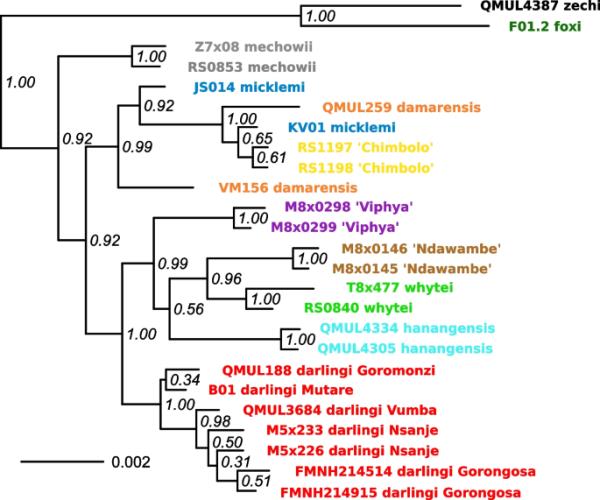
福科氏鼹鼠的核系统发育。从5个基因的核数据集估计MCC树。尖端标签与范围图和线粒体树中显示的标签颜色匹配(图1和图4)。每个尖端名称包含样品ID,各自CYTB谱系的名称,并且在F. darlingi分支样品的情况下,还包含收集地点的名称
的生殖、产后发育和两性异形f . darlingi从Nsanje
来自Nsanje的Fukomys darlingi一年四季都在两个实验室里繁殖。根据正常繁殖家庭的观察,平均产仔间隔为111±4.7天(n = 80胎,19只),平均产仔数为2.3±1.1 (n = 138胎)(表1)。但在České bud
在出生的那天,幼崽是粉红色的,如果有的话,只有稀疏的毛发,头上有一个明显的白色斑点,这使得个体识别成为可能。眼睛是闭着的,突出的颊外门牙已经很明显了。幼崽的平均体重为9.8±1.7 (n = 50窝108只幼崽)(表1)。幼崽的体重不受窝产仔数的影响(t = - 1.003;d.f. = 1;p = 0.318;N = 108只幼崽,50窝幼崽)。
幼崽在大约两周大的时候离开巢穴,也开始吃固体食物。它们的眼睛在7周大的时候就睁开了,在这个年龄,幼崽们开始和其他幼崽打架。他们出生后发育缓慢;32只雄性(13只繁殖者,19只不繁殖者)和40只雌性(13只繁殖者,27只不繁殖者)520周的生长轨迹见图6。研究发现,性别对渐近体质量a、拐点I和最大生长率有显著影响,但对生长常数K没有影响(图7,表2)。育种状况对渐近体质量有影响,但对其他参数没有影响。性别和繁殖状况的综合效应对所有参数(K、I和最大生长率)均有统计学显著影响,但对渐近体质量无显著影响。出生后80天的平均生长量平均为0.37±0.08 g/d, 4个状态组间差异有统计学意义(单因素方差分析,F3,64 = 5.47;p = 0.002)。Tukey HSD检验显示,雄性育种者(0.43±0.06 g/d)与雌性非育种者(0.33±0.07 g/d)差异显著;padj < 0.0015);其他多重比较之间的差异不显著。成年(≥18个月)雌性圈养鼠体重为114±15.4 g (n = 51),雄性圈养鼠体重为153.6±22.6 g (n = 45),因此略高于野生Nsanje鼹鼠(表1)。

从恩桑杰种群中圈养的福科米达林吉的增长。根据性别和繁殖状况,属于四组之一的个体每周计算的平均体重(g)(非繁殖雌性NB, n = 27;繁殖雌性B, n = 13;非繁殖雄性NB, n = 19;繁殖雄性B, n = 13),持续10年。分别估计每个个体的Gompertz生长参数,然后计算每组的平均值。这些参数已用于实线的建模
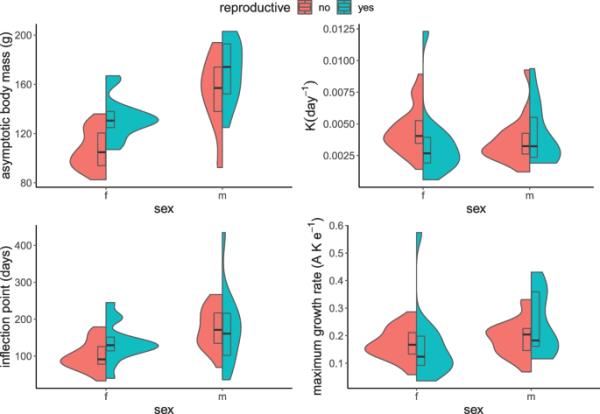
小提琴图显示生长参数(A、K、I和最大生长率)的分布,分别计算了来自Nsanje种群的73只Fukomys darlingi个体
有繁殖能力的雌性至少可以繁殖到14岁,但在撰写这篇手稿时,这些动物仍在繁殖。Nsanje鼹鼠仍然可以在8-10岁时成功地进行第一次交配,并且通常很长寿,这是典型的Fukomys属。最长寿命至少为19年,因为2005年被困在野外的一只雌性,估计只有1岁,于2023年1月在南波希米亚大学的动物园内死亡。
讨论
植物的系统发育、多样性和生物地理学f . darlingi
我们证明了来自Nsanje的鼹鼠在f.d arlingi中形成了一个嵌套谱系,考虑到现有的遗传和核数据,这些动物的物种或亚特异性地位是没有根据的。在连接的核树中,Nsanje种群甚至没有被发现是单系的,根据CYTB数据,它与其他F. darlingi的平均距离与物种的总体变异性相当。因此,达林芝种群之间显著的形态和生殖差异并不与系统发育距离一致,而是与种内差异相对应。因此,我们建议将F. darlingi保留为单型物种,这是目前的共识(Honeycutt, 2016;Monadjem et al., 2015)。
在核系统发育中,F. darlingi形成了whytei-hanangensis-“Viphya”-“Ndawambe”分支的姐妹谱系(PP = 0.99)(图4)。这种关系将使该物种成为Fukomys东部非洲辐射的一部分,Fukomys在非洲东南部的主要分支中筑巢,其物种占据从坦桑尼亚到赞比亚东北部、马拉维和津巴布韦的大草原环境。与此同时,这种推断的姐妹群关系使f.d arlingi成为有丝核不一致的一个明显例子,因为在CYTB树中,谱系被明确地支持(PP = 1.00)作为由f.d amarensis和f.m icklemi s.l对应的五个谱系形成的分支的姐妹(图4)。这种不一致可能是由于谱系分类不完整造成的,这在经历了祖先物种形成事件的快速继承的辐射中尤其常见。它也可能是由微达马种的祖先向达林种的遗传渗入(反之亦然)造成的。F. darlingi和F. damarensis主要分布在赞比西河以南。
考虑到它们在达林吉虫谱系中的筑巢位置,以及所有其他达林吉虫的记录都来自津巴布韦东部赞比西河以南和莫桑比克邻近地区,看来恩桑杰达林吉虫的祖先很可能越过赞比西河,在马拉维南部定居。虽然鼹鼠的身体呈圆柱形,手脚宽阔,所以它们一般都能游得很好(Hickman, 1978),但我们没有想到它们能主动渡过这么大的河流,尤其是在下游。另一种可能是,河道的变化可能会反复隔离和释放部分鼹鼠种群,从而使恩桑杰鼹鼠的祖先能够先后克服这一障碍。事实上,赞比西河及其支流以河道上有标记的牛弓而闻名。有人提出了类似的扩散类型来解释Nothobranchius属的年生鳉鱼(即不栖息在溪流中并且游泳能力很差的鱼类)如何穿越莫桑比克低地洪泛平原大河的下游(Bartáková等人,2015)。
我们想简单地谈谈两种被认为是社会性鼹鼠的情况,它们已不再被分类学家所认识。这两种物种都是在莫桑比克低地地区的贝拉附近被描述的,即Georychus beirae Thomas & Wroughton, 1907年(后来的Cryptomys beirae -见Roberts, 1951年)和Cryptomys zimbitiensis (Roberts, 1946年)。最初分配给这些物种的动物实际上彼此无法区分(De Graaff, 1964),目前两者都与F. darlingi同义(Happold, 2013;哺乳动物多样性数据库,2022)。这些鼹鼠被描述为比命名的f.d arlingi稍大,皮毛颜色更浅,更黄(De Graaff, 1964)。除了在贝拉附近发生外,在戈龙戈萨也有报道(Roberts, 1951;参见De Graaff, 1964)。我们的研究结果清楚地表明,戈龙戈萨的鼹鼠与恩桑杰的鼹鼠有密切的关系。Roberts(1951年)对鼹鼠的描述与恩桑杰鼹鼠的身体测量(头部和体长,后脚)一致,包括头部有一块白色斑块。这两个种群都大于津巴布韦高地的提名F. darlingi (Roberts, 1951;托马斯,1895)。对F. darlingi (NHMUK 1895.7.16.4)和berae形式(NHMUK 1907.6.2.98)的全模检查没有发现它们的皮毛颜色有任何显着差异(见补充信息4)。考虑到这些数据,在F. darlingi中保留所有标记为berae和zimbitiensis的标本似乎是合适的。
有多少Fukomys有什么物种栖息在马拉维?
虽然最初认为马拉维常见的鼹鼠属于一个单一的物种,被称为Cryptomys hottentotus (Ansell & Dowsett, 1988),但很明显,该国至少有四个定义明确的Fukomys谱系,很可能是不同的物种(图1、4和5)。马拉维北部地区由F. whytei占据,而在马拉维最南端地区,F. darlingi存在。另外两个暂时命名为“Ndawambe”和“Viphya”的血统出现在该国中部。尽管在CYTB和核数据集中,来自Viphya的鼹鼠似乎与F. whytei有关,但来自Ndawambe的鼹鼠的位置尚不清楚(图4和5)。根据我们未发表的CYTB数据,来自马拉维北部Mzuzu的鼹鼠(见Faulkes等人,2010)似乎与来自Viphya的动物几乎相同。当然,这些相对孤立的谱系值得进一步研究。Ansell和Dowsett(1988)提出,在赞比亚北部大量存在的巨型鼹鼠F. mechowii (Peters, 1881)也存在于马拉维北部。然而,这一假设所基于的单个标本显示出一个头部斑点,这在该物种中通常是不存在的(Caspar et al., 2021b)。从那以后,马拉维没有进一步的mechowii记录,而且该物种的东部活动范围似乎受到赞比亚Muchinga陡崖和卢安瓜河系统的限制(见Caspar et al., 2021b)。因此,其范围不应延伸到马拉维。如果马拉维确实没有f.m howii,而在未来的分析中,Ndawambe和Viphya的鼹鼠种群被认定为物种,那么该国的深海动物群将由5个物种组成:4个群居的Fukomys和独居的银色鼹鼠Heliophobius argenteocinereus。
内部核型分化f . darlingi
来自恩桑杰的达林氏F. darlingi的核型与在津巴布韦戈罗蒙齐(Goromonzi)取样的提名型非常相似。两者均具有二倍体数2n = 54 (Aguilar, 1993,本研究),但常染色体基数存在偏差(本研究aFN = 76, Aguilar的研究aFN = 80)。Aguilar(1993)报告了在我们的样本中无法识别的三对亚异心染色体。由于Aguilar(1993)提出的核型图难以区分亚超中心染色体和远中心染色体,因此很可能Nsanje和nominate F. darlingi的核型根本没有区别。
体型的变化f . darlingi
来自Nsanje的f.d arlingi种群与在Goromonzi研究的命名形式之间最显著的差异之一在于它们的体重。Nsanje野生捕获的鼹鼠几乎是比勒陀利亚大学用来建立圈养繁殖群的Goromonzi鼹鼠个体的两倍(Bennett et al., 1994;Goromonzi的提名型成虫的平均体重为70.6 g(±7.5 g;N = 8),女性92.6 g(±12.4 g;n = 10) (Bennett et al., 1994;Gabathuler et al., 1996;赫布斯特和贝内特,2001年),而它被发现是114克(±15.4克;n = 51), 18个月以上的Nsanje男性为153.6 g(±22.6,n = 45)(表1)。津巴布韦人F. darlingi也是如此(Bennett et al., 1997)。有趣的是,Genelly(1965)报道了在哈拉雷的一个鼹鼠种群中,雄性体重为110 g (80-156, n = 16),雌性体重为87 g (50-114, n = 13)。哈拉雷是达林氏梭菌的类型地区(离戈罗蒙兹不远)。戈罗蒙齐的鼹鼠似乎是达林氏鼠中最小的代表,实际上是目前已知的所有福科米中最小的。
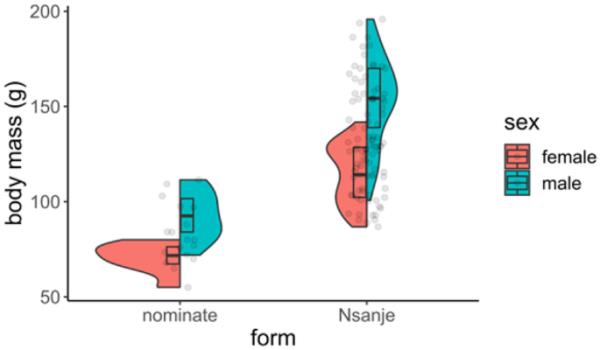
来自津巴布韦(提名型,n = 18)和马拉维南部(恩桑杰型,n = 96)的达林狐猴成年体质量分布。注意来自恩桑杰的动物更大的体重和更大的性别二态性。Goromonzi地区达林氏F. darlingi个体数据汇编自Bennett等人(1994)、Gabathuler等人(1996)和Herbst和Bennett (2001);当动物被认定为繁殖者时,或者当它们在各自的家庭中作为同性繁殖者体重更重时,就被认为是成年动物。在18个月大时,将Nsanje鼹鼠归类为成年鼠
毛发颜色
Happold(2013)将F. darlingi的命名形式描述为一种在腹部有纵向白色条纹的动物,该条纹可能沿着身体的整个内轴线延伸。其他作者没有提到过这样的条纹,我们也没有在博物馆的标本中发现它们,包括全模标本。这在恩桑杰种类中也没有,但有些个体有从下巴到喉咙的白色斑纹。在其他种类的Fukomys,如F. damarensis, F. anselli和F. micklemi,腹部内侧条纹的存在也是一个多态特征(pers)。奥林匹克广播服务公司)。Nsanje鼹鼠头部斑点的大小和形状与来自哈拉雷的F. darlingi对这一特征的详细描述非常吻合(Genelly, 1965)。来自Goromonzi的动物也表现出一个大的头部斑点(见图2)。与来自Nsanje的板岩灰色动物相比,来自Goromonzi的F. darlingi通常具有更浅的棕色(补充信息4)。然而,我们可以假设皮毛颜色没有分类学价值,因为在同一地点捕获的不同科之间,甚至在哈拉雷的F. darlingi科中,发现了从浅棕色到深灰色的巨大差异(Genelly, 1965)。此外,在德国杜伊斯堡-埃森大学(University Duisburg-Essen)实验室的两个繁殖组中,还观察到了灰毛父母所生的棕色幼崽。奥林匹克广播服务公司)。这些幼鱼的棕色在大约18个月大的时候变成了石板灰色。在其他被捕获的恩桑杰鼹鼠家庭中,这种模式并不明显。而一些种类的Fukomys,如F. anselli和F. mechowii,表现出充分记录的个体发生颜色变化(Burda, 1989;Scharff et al. 1999),到目前为止,F. darlingi还没有描述过这一特征。在老年动物(> 12岁)中,我们注意到皮毛,特别是头部的皮毛,逐渐变白。
o生殖和繁殖
在几个生殖参数上,来自Nsanje的鼹鼠与大小相似的Fukomys物种,尤其是达玛氏鼹鼠,比指定的同种鼹鼠更相似。例如,F. damarensis的新生儿体重为8-9克(Bennett & Jarvis, 2004;Bennett et al., 1991),但来自戈罗蒙兹的F. darlingi含量为6.9-8.2 g。平均产仔数的差异也很显著,达玛氏F. (Bennett & Jarvis, 2004)为3.0(1-6)只,研究的Nsanje f.d arlingi为2.3只,而戈罗蒙齐的f.d arlingi只有1.7只(Bennett et al., 1994)。虽然来自哥罗蒙兹的达林f.d arlingi的产仔量较小可能归因于它们较小的体型,但也可能是由于该种群的低样本量仅为n = 2(表1)而造成的人为影响。尽管根据我们的长期记录,Nsanje鼹鼠的产仔数相对较小(2.3),但在我们在České bud
达林弧菌种群间最显著的差异似乎是妊娠期的长短(即生育间隔)。假设最小生育间隔对应于最大妊娠期(如F. anselli, cf. Burda, 1989, 1990),我们估计来自Nsanje的F. darlingi的妊娠期约为111天。这符合典型的Fukomys模式:98天在F. anselli (Begall & Burda, 1998;Burda 1989);在F. mechowii存活112天(Scharff et al., 1999);F. damarensis的78-92天(Bennett & Jarvis, 1988, 2004)。我们发现恩桑杰型的妊娠期比报道的津巴布韦达林吉夫氏菌的妊娠期长得多。对于这些动物,Bennett等人(1994)和Herbst和Bennett(2001)报告的妊娠期仅为60天左右(表1)。由于报告的样本量非常低,很难评估这是真正的种群间差异,还是观察到的人为影响。观察到的交配事件并不一定会导致成功的受精,此外,众所周知,Fukomys的雌性即使已经怀孕也会进行交配(Burda, 1989),这使得基于这种行为测量的估计值得怀疑。还应该提到的是,如此巨大的种内妊娠期差异对于小型哺乳动物来说是非常不寻常的(Kiltie, 1982)。有趣的是,报道的戈罗蒙兹达林氏f.d arlingi产羔间隔或配对到分娩的时间跨度的最低值与我们研究中的平均产间间隔非常吻合(Bennett et al., 1997;Greeff & Bennett, 2000)。这可能表明津巴布韦种群的怀孕时间被低估了。然而,这个话题确实值得进一步研究。
Gompertz生长参数的比较(表3)表明,来自Nsanje的F. darlingi具有最低的生长常数和最低的最大生长速率(0.19 g/d)。这与我们在实验室的观察结果一致,表明这些动物可能在2岁时仍在生长,此时同类物种被认为是完全成年的。由于许多报道的物种生长参数的渐近值远低于实际体重,很明显,这些计算是基于不完整的记录(即动物未完全生长),这导致了对生长常数的高估(详见Begall, 1997)。从Nsanje获得的F. darlingi的生长常数略低于其他可获得可靠数据的Fukomys物种(如F. anselli - Begall & Burda, 1998, F. mechowii - Scharff et al., 1999),但仍处于同一数量级(表3)。
性别之间(以及繁殖者和非繁殖者之间)的生长参数差异在80天以上的动物中也很明显,反映了Fukomys鼹鼠典型的性别大小二态性(Caspar等,2021c)。(未来的)雄性育种者与雌性非育种者出生后80天的平均生长率之间的差异可能是育种者选择制度的人工产物。由于最初的雄性种群非常小(n = 4),第一代后代中体型较大、生长迅速的雄性可能被优先选择作为新家族的创始人。
以前对F. darlingi的寿命唯一可用的估计是7年(Greeff & Bennett, 2000)。我们的数据表明,该物种的最长寿命要长得多,即至少有19年。这与其他Fukomys物种记录的数据更吻合,它们的寿命可能超过20年(Begall等人,2021;Dammann珀耳斯。com。Fang等人,2014)。
是什么导致了人口间的差异f . darlingi?
各种形态参数的种间和种内差异往往与各自种群所面临的生态条件有关。最著名的解释体重差异的生态规则之一是伯格曼规则,该规则宣称,在吸热脊椎动物的进化分支中,生活在较冷环境中的动物比来自较温暖栖息地的动物要大(伯格曼,1847)。F. darlingi的范围确实覆盖了环境温度明显不同的地区,这主要与海拔有关。例如,Nsanje靠近海平面,而Goromonzi位于海拔1000米以上。因此,种内体重模式与Bergmann规则相反,较小的鼹鼠占据较高的海拔(表1)。在地下哺乳动物中,南美的Ctenomys属的tuco-tucos已经描述了与Bergman规则相反的情况(Medina et al., 2007)。不幸的是,由于缺乏数据,很难估计哪些其他因素,如不同的土壤或食物特征,可能在形成如此巨大的体重差异中发挥作用。
在F. darlingi的研究中,体重的变化似乎确实是造成许多不同研究中所描述的种群间差异的原因。除了与繁殖有关的参数外,另一个例子是保持稳定的核心体温的能力。然而,来自指定种群的较小的达林氏F. darlingi在低环境温度下缺乏这种能力,并表现出异温性的迹象(Bennett等人,1993),而来自Nsanje的同种虫则是真正的恒温动物,使它们的体温在相当大的实验环境温度范围内保持稳定(zemanov


