摘要
利用紫色马铃薯块茎和衍生的红色突变块茎进行了代谢组学比较分析,以研究花青素生物合成的调控。代谢组分析发现19种关键差异代谢物,包括10种黄酮类化合物和4种核苷酸。作为一种差异代谢物,天竺葵苷对突变负责,其他代谢物与之相关。为了进一步分析差异代谢物的调控机制,我们进行了代谢组和转录组的相关分析。差异代谢物中,7种黄酮类化合物和F3 ' 5'H在黄酮类化合物代谢途径中。F3 ' 5'H负责马铃薯块茎花青素生物合成分支。为了进一步分析F3’5’h的调控机制,转录组分析鉴定出63个与F3’5’h高度相关的差异表达基因。此外,关键差异代谢物与差异表达基因之间的相关性表明,11个差异基因与10个差异代谢物存在76个显著相关。这11个基因主要编码丝氨酸/苏氨酸蛋白激酶、UMP-CMP激酶、MADS-box转录因子和WD重复蛋白。10种差异代谢物分别为天竺葵苷、木犀草素、山奈酚-3- o -芦丁苷、碘二醇-7- o -葡萄糖苷和单磷酸尿苷。通过酵母单杂交实验,筛选出与F3’5’h启动子相互作用的蛋白:乙烯应答转录因子ERF011、赤霉素调节蛋白9-like、丝氨酸-苏氨酸蛋白激酶转录因子LHW bHLH。这些结果将为马铃薯花青素生物合成分支的调控机制提供有价值的见解。
介绍
马铃薯(Solanum tuberosum L.)是世界第五大栽培作物,已被视为主要粮食作物之一。在一些马铃薯品种的红色和紫色块茎中,花青素积累(Giusti et al. 2014;Brown et al. 2007;Han et al. 2006)。花青素具有优异的抗氧化性能(Galvano et al. 2004;之前2004;Beattie et al. 2005),因此可以保护人类免受许多慢性疾病的侵害,如癌症、记忆障碍和糖尿病(Long et al. 2018;Chen et al. 2019;Yan et al. 2016;Saito et al. 2016)。由于花青素的功效和马铃薯的重要作用,研究马铃薯花青素的生物合成对改善公众健康具有重要意义。
花青素是类黄酮化合物,按羟基和甲基的数量大致可分为六类,分别是花青素、花青素、飞燕素、芍药苷、矮花苷和马柳苷(Martin and Gerats 1993)。花青素的相对含量和种类决定了水果和其他器官的最终颜色(Cutanda-Perez et al. 2009;Castellarin et al. 2006)。
花青素是生物合成的,从苯丙氨酸开始,通过所谓的花青素生物合成途径。在这一途径中,二氢山奈酚参与了花青素、花青素、花青素和飞鸽素的三个生物合成分支(Holton和Cornish 1995;Bogs et al. 2006),它们也通过糖基化、甲基化和酰化来生物合成其衍生物(Cavallini et al. 2014)。这些分支分别由类黄酮3′,5′-羟化酶(F3′5′h)和类黄酮3′-羟化酶(F3′h)控制(Jeong et al. 2006)。F3'5'H负责蓝飞燕素基花青素的生物合成(Lu and Yang 2006;Wessinger and Rausher 2015),而F3'H负责紫色花青素基花青素的生物合成(Momose et al. 2013)。没有F3'5'H和F3' h,红天竺竺素是生物合成的(Holton和Cornish 1995;Liu et al. 2018)。F3 ' 5 ' h作为控制花青素生物合成的关键酶,催化二氢黄酮醇3 '和5 '位点的两个羟基氧化,生成基于飞蓟草苷的花青素(Olsen et al. 2010)。此外,编码该酶的基因已在许多物种中被克隆,如马铃薯、葡萄和石斛(Momose et al. 2013;Whang et al. 2011;Falginella et al. 2010)。虽然F3 ' 5'H的作用机制和编码该酶的基因已被研究,但调控该酶的基因和代谢物及其调控机制尚不清楚。
随着组学技术的发展,通过结合代谢组、转录组和蛋白质组的分析,在许多植物中深入研究了花青素的生物合成(Degu et al. 2014;Tohge等人,2005;Wang et al. 2017a)。在葡萄中,通过代谢谱和转录数据,花青素积累的调控依赖于葡萄品种(Degu et al. 2014)。对拟南芥代谢组和转录组的综合分析发现了几个参与花青素生物合成的新基因(Tohge et al. 2005)。玉米转录组和代谢组的动态揭示了初级代谢与花青素积累之间的关系(Hu et al. 2016)。代谢组学和蛋白质组学分析揭示了葡萄和无花果花青素积累动态(Wang et al. 2017a, b)。代谢物和转录谱分析揭示了茶树花青素平衡的分子调控(Mei et al. 2021)。
此前,我们通过对野生紫薯SD92及其红色突变体SD140的比较转录组分析,广泛讨论了花青素转化的候选基因(Liu et al. 2018)。SD140是通过SD92块茎切片离体再生获得的。本研究鉴定了SD92和SD140之间的差异代谢物,并进一步探讨了它们之间的关系,以获得调节花青素生物合成的候选代谢物。此外,通过差异代谢物与差异基因的相关分析,研究了马铃薯F3 ' 5'H调控花青素生物合成分支的分子机制。本研究结果将丰富花青素代谢途径的相关信息,有利于培育花青素丰富的马铃薯品种。
材料与方法
植物材料
采用紫皮紫肉块茎的四倍体SD92和从离体再生的SD92块茎切片中鉴定的红皮紫肉突变体SD140 (Liu et al. 2018)。SD92和SD140在山东省农业科学院蔬菜花卉研究所的大棚内按正常播种时间(2016年8月10日)在济南种植。将收获的新鲜块茎(直径4-5厘米)切成小块,然后放入液氮中冷冻。每种材料有6个生物重复,分别为SD92-1、SD92-2、SD92-3、SD92-4、SD92-5、SD92-5、SD92-6、SD140-1、SD140-2、SD140-3、SD140-4、SD140-5、SD140-6。
抽走我tabolites
冷冻后的块茎用砂浆在液氮中研磨成粉末,将100 mg粉末转移到5 ml离心管中,与预冷(- 20°C) 1000 μL甲醇(Thermo,美国)混合,旋涡30 s,然后超声30 min。超声后加入750 μL氯仿(Sigma,美国),加入800 μL ddH2O(4℃预冷),涡流1 min, 4℃下10000 rpm离心10 min,收集1000 μL上清,真空离心浓缩器浓缩,进行代谢组学分析。
我tabolite剖面分析
采用超高效液相色谱(UPLC) (UHPLC LC-30A, Shimadzu,日本)和三重四极杆飞行时间串联质谱(triple - tof - MS/MS) (triple TOFTM 5600 System, AB,美国)对12份样品的代谢物谱进行分析。实验前,将4个重复的所有样品提取物混合,在正、负ESI模式下进行代谢物谱分析,以进行质量控制。色谱柱为Acquity UPLC BEH C18 (2.1 mm × 100 mm × 1.7 μm;以超纯水中的0.1%甲酸(TCI,日本)为流动相A, 0.1%甲酸在乙腈中(Thermo,美国)为流动相B,样品洗脱的梯度条件为:保持2%的B流动相0.5 min;流动相B从0.5 min时的2%线性增加到9 min时的50%,再到12 min时的98%,然后保持在98%直到13 min;最后,溶剂B在14 min时降至2%。流速保持0.4 mL min - 1,柱温固定为40℃。自进样器温度保持在4℃,每次进样量为2 μL。在正、负ESI模式下均进行了大量数据采集,操作流程为:正ESI模式下离子喷雾电压为5.5 kV,负ESI模式下离子喷雾电压为- 4.0 kV;正ESI模式下为80 V,负ESI模式下为- 80 V;源温度600℃;幕气35psi:气体1(雾化器气体)60psi和气体2(加热器气体)65psi。质谱测定采用全扫描法,范围50-1000 m/z。
多元统计分析
质谱数据(wiff文件)通过Proteowizard软件(版本3.0.8789)中的MSConvert转换为mzXML文件。转换后的原始数据通过运行在R(版本3.2.3)下的XCMS软件进一步处理,并作为保留时间和m/z数据集输出。使用SIMCA-P软件包(版本13.0)对每个样本的质量峰强度进行和归一化和帕累托缩放。利用主成分分析(PCA)和偏最小二乘判别分析(PLS-DA)对12份马铃薯材料的代谢成分进行分析。为了防止PLS-DA模型的过拟合,共进行了100次随机排列检验。采用R2和Q2评价PLS-DA模型。R2X和R2Y表示x和y变量在组件中建模的方差的百分比,而Q2Y表示预测性能。
生物标志物的筛选和鉴定
通过PLS-DA模型的s图计算所有代谢物和第一组分的[p (corr)]值。被鉴定为潜在标记物的代谢物满足以下标准:(i)在SD92和SD140之间的区分上具有高置信度[|p(corr)| > 0.8];(ii) SD92的平均强度与SD140有显著差异(p < 0.05);(iii)影响强度高,解释能力强[投影变量重要性(VIP) > 1]。p值采用独立双样本t检验计算。
根据代谢物的精确分子量对其进行确证,并推测代谢物可能的经验公式(分子量误差≤20ppm)。然后,通过在人类代谢组数据库(http://www.hmdb.ca/)、Metlin (http://metlin.scripps.edu/website)、massbank (http://www.massbank.jp/)和脂质图谱(http://www.lipidmaps.org)中绘制准确的分子量来识别潜在的生物标志物。通过将代谢产物的质谱和保留指数与数据库中发现的代谢产物进行比较,在截断值为85%的情况下进行了确认。
我tabolite分析
对差异代谢物的原始数据,即质量峰的强度进行和归一化和缩放,然后分别在R(3.2.3版本)中进行分层聚类分析(HCA)和生成差异代谢物的pheatmap。对差异代谢物的质量峰强度进行求和归一化,然后使用R(3.2.3版本)中的cor()和cor.test()进行代谢物相关性分析。
京都基因与基因组百科全书(KEGG)tabolites
在KEGG分析中,获得了差异代谢物的化合物数,并在互联网上(https://www.genome.jp/kegg/pathway.html)将差异代谢物映射到相应的KEGG途径。
me的相关分析tabolome和Transcriptome
本实验代谢组数据中的差异代谢物与前人研究转录组数据中的差异表达基因计算Pearson相关系数(Liu et al. 2018)。进行假阳性检查,当假发现率在R(3.2.3版本)中p≤0.05时,认为相关性显著。
差异表达基因的实时qRT-PCR验证
为了验证由这些差异基因和差异代谢物组成的网络中的差异基因,我们进行了实时qRT-PCR。基因特异性引物列于表S1。用2微升cDNA作为模板,在20 μ l的反应体积中,使用2×SYBR Green Pro Taq HS预混料(Accurate Biotechnology, China)。采用7500 Real-Time PCR (ABI, USA)进行qPCR反应。qPCR条件为95℃下5 s, 60℃下30 s, 40个循环,65 ~ 95℃熔融曲线检测。以18S RNA为内参基因,分析了3个生物重复。
酵母单杂交试验
酵母单杂交(Y1H)检测采用Matchmaker™Gold酵母单杂交文库筛选系统(Takara,日本)。将F3’5’h启动子的196 bp和307 bp两个序列克隆到pAbAi载体中。利用克隆miner II试剂盒(Invitrogen, USA)构建SD92和SD140 cDNA初级文库,将初级文库插入pGADT7载体构建二级文库。二级文库转化为Y1H Gold菌株。通过在不含亮氨酸但含有300 ng·mL-1金黄色葡萄球菌蛋白a的合成葡萄糖板上生长共转化子来评估dna -蛋白相互作用。
目录
摘要 介绍 材料与方法 结果 讨论 结论 参考文献 致谢 作者信息 道德声明 补充信息 搜索 导航 #####结果
全球我紫薯及其红色突变体代谢差异研究
通过UPLC-Triple-TOF-MS获得的数据通过PCA进一步处理,比较紫色块茎及其红色突变体的代谢物组成。主成分分析结果显示,在正ESI模式下,前两个主成分(PCs)解释了39.3%的总方差(图S1a);前两个pc解释了负ESI模式总方差的43.4%(图S1b)。这些结果表明,SD92和SD140在PC1 × PC2评分图中明显分离。
利用PLS-DA模型的计分图分析SD92与SD140的差异(图1a和b)。两种ESI模式下的R2Y和Q2值(表1)表明数据拟合良好,模型的预测能力较强。PLS-DA排列检验结果显示,所有排列后的Q2值都低于R2值的原点(图S2a和S2b)。结果表明,两种ESI模式下PLS-DA模型都是有效可靠的。
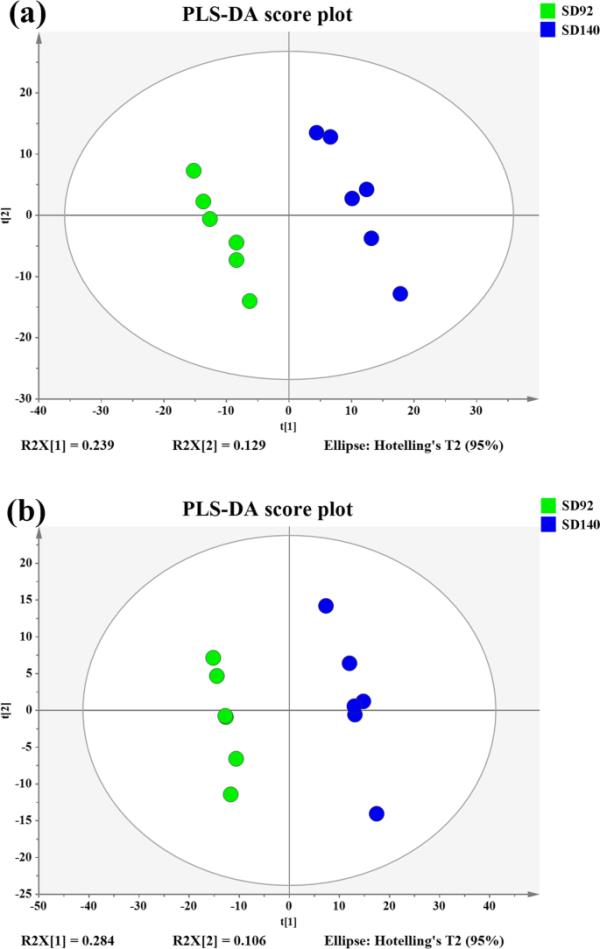
紫色马铃薯及其红色突变体PLS-DA模型评分图。(a)正ESI模式。(b)负ESI模式
生物标志物的筛选和鉴定
在正ESI模式下,共鉴定出259个质量离子作为候选生物标志物,其中105个离子在SD92中表达上调,154个离子在SD140中表达下调(图2a和b)。在负ESI模式下,共筛选出491个质量离子,其中SD92中有152个离子表达上调,SD140中有339个离子表达下调。
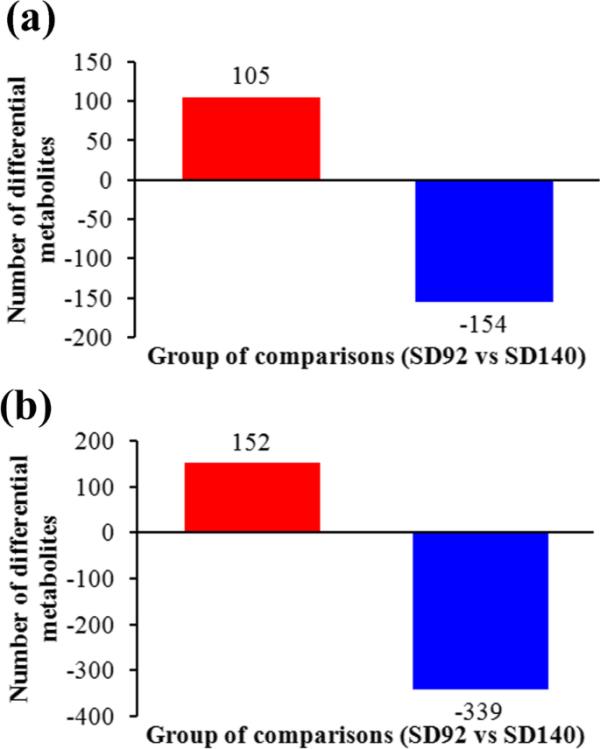
紫色马铃薯及其红色突变体差异的候选生物标志物。(a)正ESI模式。(b)负ESI模式
为了进一步确定这些候选生物标志物的化学结构,我们还在两种ESI模式下对其分子离子进行了MS/MS分析。得到了二级质谱。与上述数据库比较,鉴定了这些生物标志物的化学结构,ESI阳性模式下检测到10种代谢物(表2),ESI阴性模式下检测到11种代谢物(表3)。
我tabolite相关分析
为了研究SD92和SD140之间代谢物谱可能存在的差异,对12个样本进行了HCA。结果显示,SD92聚为一类,SD140聚为另一类(图3),表明检测到的差异代谢物可以有效区分两组样品。为了进一步研究花青素生物合成分支的调控模式,我们通过HCA评估了鉴定出的19种代谢物之间的关联。结果表明,这些代谢物可分为两类。其中一组含有11种代谢物,SD140的相对含量高于SD92。这一组主要含有黄酮类化合物,如天龙苷、山奈酚-3- o -芦丁苷、芹菜素和木犀草素(表2)。另一组由l-谷胱甘肽、13-HpOTrE、4-氨基苯甲酸、松木素-3-葡萄糖苷和一组核苷酸组成,其含量在SD140中低于SD92。
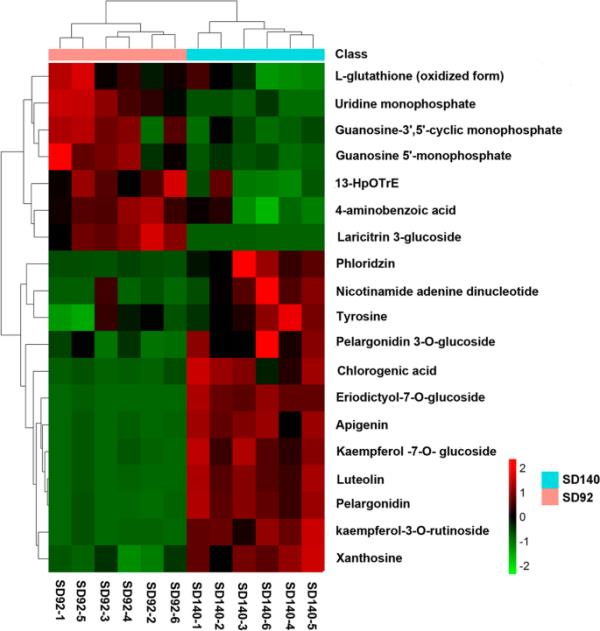
紫薯与红色突变体代谢物差异的聚类分析
为了研究差异代谢物之间的关联,进行了Pearson相关系数分析。l -谷胱甘肽、单磷酸尿苷、5′-单磷酸鸟苷、3′,5′-环单磷酸鸟苷被定义为第一类,它们之间存在显著正相关关系。第II组由绿原酸、芍药苷-7- o -葡萄糖苷、芹菜素、山奈酚-7- o -葡萄糖苷、木犀草素、天竺葵苷、山奈酚-3- o -芦丁苷、天竺葵苷-3- o -葡萄糖苷和黄嘌呤组成,且它们之间呈显著正相关。ⅰ组与ⅱ组的核苷酸均呈显著负相关。白龙苷与苯丙素、烟酰胺腺嘌呤二核苷酸呈显著正相关。天竺葵苷和天竺葵苷-3- o -葡萄糖苷与13-HpOTrE、4-氨基苯甲酸、laricitrin -3-葡萄糖苷呈显著负相关。山奈酚-3- o -芦丁苷或山奈酚-7- o -葡萄糖苷与苯连菌素、烟酰胺腺嘌呤二核苷酸和酪氨酸呈显著正相关。山奈酚-3- o -芦丁苷与l-谷胱甘肽呈显著负相关。Laricitrin 3- gluco甙与苯三嗪、烟酰胺腺嘌呤二核苷酸呈显著负相关。
我代谢途径参与分化代谢tabolites
通过KEGG分析分析这些差异代谢物及其相关合成前体的途径。结果表明,SD140代谢产物上调主要与黄酮类生物合成、儿茶酚胺生物合成、氧化磷酸化和氨基酸生物合成途径有关(表4)。黄酮类生物合成包括黄酮类和黄酮醇生物合成、花青素生物合成、芹菜素生物合成、木犀草素生物合成和绿原酸生物合成。氨基酸的生物合成主要包括苯丙氨酸、酪氨酸和色氨酸的生物合成。SD140中下调的差异代谢物主要涉及嘧啶代谢、嘌呤代谢、谷胱甘肽代谢和生物碱生物合成等途径(表5)。
me的相关分析tabolome和Transcriptome
为了探索差异代谢物的起源,我们对差异代谢物与差异基因之间的代谢途径进行了相关性分析。结果表明,F3′5′h和7种差异代谢物,即天竺葵苷、天竺葵苷-3- o -葡萄糖苷、芹菜素、绿原酸、木犀草素、山奈酚-7- o -葡萄糖苷、杉木苷参与了黄酮类化合物的生物合成途径。在该代谢途径中,天竺葵苷、天竺葵苷-3- o -葡萄糖苷、木犀草素、绿原酸、芹菜素、山奈酚-7- o -葡萄糖苷含量升高,杉木苷含量降低。为了研究调控F3’5’h表达的基因和代谢物,筛选与F3’5’h高度相关的差异基因(r2 > 0.8)。分析这些筛选的差异基因与差异代谢物之间的相关性,然后构建一个网络。
相关分析发现63个差异表达基因与F3’5’h高度相关(表S2)。这些基因主要编码酶、转录因子和未知蛋白质。这些酶主要包括合成酶、转移酶、氧化酶和水解酶(磷酸酶)。转录因子由富含亮氨酸的重复蛋白、WD重复蛋白和MADS-box转录因子组成。
网络结果显示,11个基因和10种代谢物存在76个显著相关,其中17个正相关,58个负相关(表S3,图4)。这些基因主要编码丝氨酸/苏氨酸蛋白激酶、脂肪酸酰胺水解酶、线粒体进口受体、UMP-CMP激酶、MADS-box转录因子和WD重复蛋白。PGSC0003DMG400008074功能未知(表S2)。编码MADS-box转录因子的PGSC0003DMG400022867和编码WD重复序列蛋白的BGI_novel_G000694在SD140中表达下调。MADS-box转录增强因子编码基因的表达与天葵苷、木犀草素、山奈酚-3- o -芦丁苷、环二醇-7- o -葡萄糖苷呈负相关,与单磷酸尿苷呈正相关。编码WD重复序列蛋白的基因表达与单磷酸尿苷呈正相关。
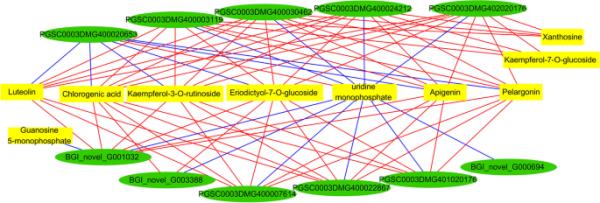
差异代谢物与差异基因的相关性分析。相关系数R2≥0.8,错误发现率(FDR) < 0.05。代谢物用矩形表示,基因用圆形表示。相关性由连接线表示。正相关为蓝色,而负相关为红色
基因的实时qRT-PCR验证压力差
为了验证网络中基因的差异表达,我们对其中10个基因进行了实时qRT-PCR。qRT-PCR结果显示,10个基因在SD92和SD140中的表达均存在差异。表达模式与转录组数据一致(图5)。
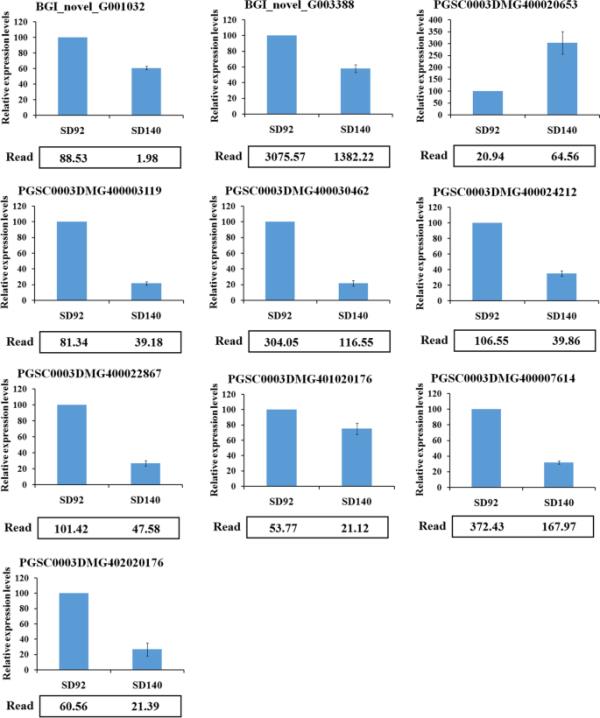
网络中差异基因表达的实时qRT-PCR验证
F3’5’h启动子相互作用蛋白的筛选
将第二个文库质粒共转化到酵母的感受态细胞中,分别为pAbAi-F3'5'H-I和pAbAi-F3'5'H-II。共转化子筛选后,分别鉴定出61个和30个阳性菌落(图6)。测序分析表明,阳性菌落的cDNA序列编码了对炔应答的转录因子ERF011、赤霉素调节蛋白9-like和丝氨酸苏氨酸蛋白激酶、转录因子lhw样Bhlh等。
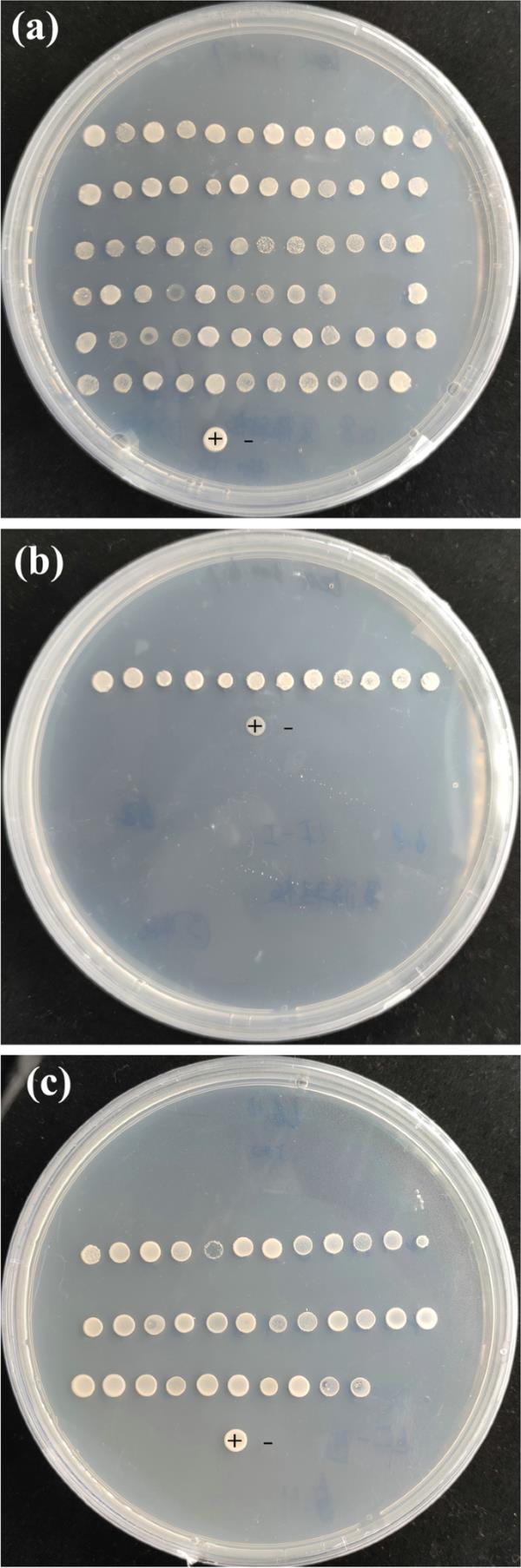
F3’5’h启动子相互作用蛋白的筛选。(a, b) paai - f3 '5'H-I。(c) 5 'h-ii pAbAi-F3”
下载原文档:https://link.springer.com/content/pdf/10.1007/s11540-022-09586-5.pdf

