摘要
α-突触核蛋白聚集构成路易体病的病理机制。对于LB病理在临床前(症状前)个体中的作用知之甚少,无论是作为单独的病理还是与阿尔茨海默病(AD)病理(β-淀粉样蛋白(Aβ)和tau)共存。我们使用脑脊液α-突触核蛋白种子扩增法检测了来自BioFINDER研究的1182名认知和神经功能未受损的参与者的LB病理学影响:8%为LB阳性,26%为a β阳性(其中13%为LB阳性),16%为tau阳性。Aβ阳性时LB阳性较多,而tau阳性时较少。LB病理对横截面和纵向整体认知和记忆以及纵向注意/执行功能有独立的负面影响。Tau蛋白对认知的影响程度相似,但对a β蛋白的影响不那么明显。同时患有LB和AD (Aβ和tau)病理的参与者比仅患有LB或AD病理的参与者表现出更快的认知衰退。LB病理与嗅觉减退有关,AD病理与嗅觉减退无关。只有LB阳性参与者在10年内进展为临床LB疾病。这些结果对于临床前LB疾病试验的个体化预后、招募和结局指标的选择很重要,而且对于早期AD试验的设计也很重要,因为>10%的临床前AD患者同时存在LB病理。
主要
路易体病理是路易体病(LBD)的主要病理,包括错误折叠的α-突触核蛋白(α-syn)聚集物在神经元内积聚,如LB和神经鞘1,2。LBD一词主要用于描述帕金森病(PD)和伴有LB的痴呆(DLB)1,2。重要的是,LB病理也经常被发现为AD3的病理。根据使用死后免疫组织化学的研究,大约8-12%的神经和认知功能未受损的老年人(“偶发LBD”)存在LB病理,平均年龄在70至75岁之间4,5,6。由于先前缺乏准确的α-syn错误折叠的生物标志物,因此对LB病理在LBD临床前(也称为“症状前”)阶段的影响知之甚少。然而,最近的研究表明,通过α-syn7的体外种子扩增实验(SAA),可以在LB病理患者的脑脊液(CSF)中检测到错误折叠的α-syn。这种新方法在神经病理学证实的LBD检测中显示出非常高的灵敏度和特异性,特别是在边缘和皮质lb8,9,10和临床诊断为PD11的个体中。目前还没有研究使用这种方法来检查LB病理对神经和认知未受损个体临床症状的横断面和纵向变化的影响,既不是作为一个孤立的病理,也不是与AD病理共存。了解这些影响对于设计临床前LBD试验,特别是计划筛选程序和选择敏感的结果测量指标非常重要。考虑到许多正在进行的阿尔茨海默病临床前试验招募认知功能正常的阿尔茨海默病患者,LB和AD病理的共存也很重要。如果LB病理具有与AD病理相似的认知效应,那么考虑LB病理存在的试验可以更好地检测抗a β治疗的效果。作为阿尔茨海默病的一种病理,根据阿尔茨海默病的框架,在检查临床前个体的认知轨迹时,考虑LB病理的存在也可能是相关的,该框架以a β (a)、tau (T)和非阿尔茨海默病特异性神经变性(N)的存在为特征,用于诊断和预后。
在这项研究中,我们旨在研究LB病理对认知和其他临床结果的早期影响,并将其与Aβ和tau病理的影响进行比较。对来自BioFINDER-1 (NCT01208675)和BioFINDER-2 (NCT03174938)研究的1182名认知和神经功能未受损的参与者进行了长达10年的认知结果横断面和纵向检查。此外,基于基线时LB病理的存在,进行了生存分析,检查随后进展为DLB或PD。
结果
参与者及预AD和LB病理的价态
参与者特征如表1所示。根据美国国家老年痴呆症协会标准12,使用CSF或正电子发射断层扫描(PET)方法将AD病理定义为Aβ和tau阳性。采用实时振荡诱导转化试验(RT-QuIC)将LB病理定义为α-syn SAA+ 8。请注意,我们应用的α-syn SAA仅检测PD和DLB中可见的LB病理,而不能检测罕见的α-syn疾病多发性系统性萎缩中的α-syn。在研究基线时确定生物标志物状态。Aβ、tau和LB病变的患病率如图1a-c所示。结果发现,94例(8%)为LB+, 304例(26%)为Aβ+, 195例(16%)为tau+, 38例(13%)为Aβ+和LB+阳性。当将AD病理定义为ab +和tau+时(参考文献12),我们发现941名(80%)参与者既没有AD也没有LB病理(AD - /LB -), 74名(6%)参与者只有LB病理(AD - /LB+), 147名(12%)参与者只有AD病理(AD+/LB -), 20名(2%)参与者既有AD又有LB病理(AD+/LB+)。随着年龄的增长,所有病理都更常见(见图1d-f和图图例中的比值比(OR))。经年龄调整后,男性患LB+的可能性是女性的两倍多(OR 2.56, 95%可信区间(CI) 1.66-3.99)。性别与Aβ或tau之间没有明显的联系。
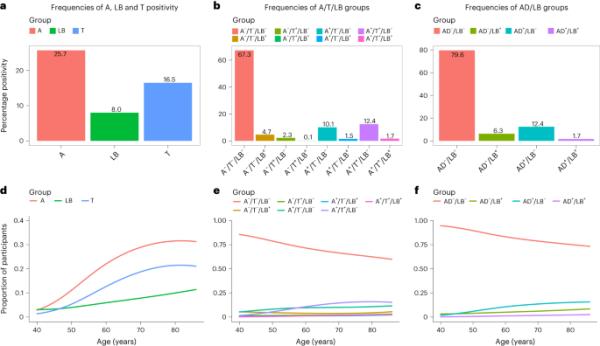
a、a β (a)、tau (T)和LB阳性的患病率。b、A/T/LB组患病率。c、AD/LB组患病率。d - f,分别为A - c组随年龄增长的比例,其中d为A、LB和T阳性,e为A/T/LB阳性/阴性组合,f为AD/LB阳性/阴性组合。注意,AD阳性是指同时为A+和T+, LB阳性是指同时为α-syn SAA+。d,在logistic回归模型中,年龄为自变量,病理为因变量,LB的年龄OR为1.066 (95% CI 1.036-1.099), A的年龄OR为1.067 (95% CI 1.048-1.087), T病理的年龄OR为1.071 (95% CI 1.048-1.095)。
Cross-sectio与临床结果没有关联
当比较基线横截面组差异时(图2a-e),与AD - /LB -的参与者相比,AD - /LB+或AD+/LB -的参与者在基线整体认知(用临床前阿尔茨海默认知复合测试(PACC)测量)和记忆(用十字延迟回忆测试测量)方面的表现明显更差。此外,AD+/LB+受试者的整体认知能力显著低于AD - /LB+受试者。当在同一模型中将这三种病理作为独立的预测因子时,LB和tau病理对较低的整体认知和记忆表现具有相似的显著影响(图2f-h)。另一方面,Aβ病理是唯一与注意力/执行功能恶化独立相关的病理,但对记忆功能没有独立影响(图2g-h)。在识别任务中进一步检查了对记忆的影响,其中只有tau与较差的表现显著相关(补充表1)。AD - /LB+或AD+/LB+的参与者嗅觉下降(图2d),并且是LB病理特异性的(图2i)。以LB状态为结果,在接受工作特征(ROC)分析中进一步检验其对LB病理的准确性。嗅觉测试预测LB病理的曲线下面积(AUC)为0.80 (95% CI为0.71-0.89,总体准确率为85%;图1)。

在调整年龄、性别和教育程度(运动功能未调整教育程度)的同时,使用线性回归模型使用两个AD/LB组(a-e)或在同一模型中对所有三种病理进行二值化(f-j)来检查显著效应(双侧)。a,f,全局认知。b, g内存。c,h,注意/执行功能。d,我的气味。e,j,运动函数。结果是z得分的认知测试(a-c, f-h),嗅觉识别测试(d,i)和基于告密者的运动问卷(e,j)。a-e,方框表示四分位数范围,水平线为中位数,胡须采用Tukey方法绘制。f-j,圆点/中心为病理估计值,误差线95% CI。红色表示病理与较差表现之间有显著关联。AD - /LB - 941例,AD - /LB+ 74例,AD+/LB - 147例,AD+/LB+ 20例;LB+ 94例,Aβ+ 304例,tau+ 195例。图2a、b显示了使用UPDRS-III量表对运动功能的影响(LB病理无显著影响)。对多个比较进行校正后的统计分析见补充图1(校正后LB病理的所有影响均显著)。扩展数据表1显示了LB对Aβ和tau蛋白调整/不调整的临床结果的影响。缺失数据见补充表2。h,当将注意力/执行功能的分析限制在具有可用SMDT数据的参与者(n = 854)时,结果一致,显示a β有显著影响(P = 0.01),而tau和LB没有显著影响。*P < 0.05, **P < 0.01, ***P < 0.001(双面)。
使用基于信息的问卷测量,与AD - /LB+或AD+/LB -的参与者相比,AD - /LB -的参与者运动功能更差,但是,当检查LB, Aβ和tau(在同一模型中)对运动功能的独立影响时,在临床前疾病阶段没有任何病理学显着(图2e,j)。当使用统一的帕金森病评定量表第III部分(UPDRS-III)作为运动功能的测量时,也证实了对运动功能没有影响(扩展数据图2)。
无论模型是否调整了Aβ和/或tau, LB病理学对认知、嗅觉和运动功能的横截面效应大小都是相似的(扩展数据表1)。
Cross-sectio与病理和萎缩的Nal关联
LB和a β状态之间存在显著相关性,在a β阳性的情况下,LB阳性更容易发生(χ2检验P = 0.001),在调整年龄时也是如此(LB的OR为1.72;p = 0.017)。LB与tau状态之间无显著相关性(P = 0.15, P = 0.41)。最后,在临床前人群中,LB状态与磁共振成像测量的灰质完整性无关(见分析方法)。
罗与认知结果的纵向关联
在线性混合效应(LME)模型中,研究了不同AD/LB组的影响以及所有三种病理(即LB、Aβ和tau)对纵向认知功能的独立影响,重点是时间× AD/LB组(图3a-c)和时间×病理(缺席/存在;图3 d-f)。组间比较显示,AD - /LB+、AD+/LB -或AD+/LB+的参与者在所有认知测试中的进展都比AD - /LB -的参与者快(图3a-c)。此外,AD和LB病理(AD+/LB+)均呈阳性的参与者在记忆和注意/执行功能方面的进展明显快于仅AD或LB病理(AD+/LB -或AD - /LB+)的参与者(图3b-c),在整体认知方面也明显快于AD - /LB+的参与者(图3a)。为了证明轨迹的差异不是由基线组差异引起的,我们以认知变化作为结果进行了敏感性分析,并根据基线认知测试分数调整了模型(扩展数据表2)。这证实了图3a-c所示的显著差异。在研究LB、Aβ和tau病理对认知进展的独立影响时,我们发现LB和tau病理对所有认知结果的影响相似,但这些对Aβ的影响不太明显(图3d-f)。经Aβ和tau调整/未调整的纵向LME模型如扩展数据表3所示(显示无论是否调整AD病理,LB病理的效应大小都相似)。
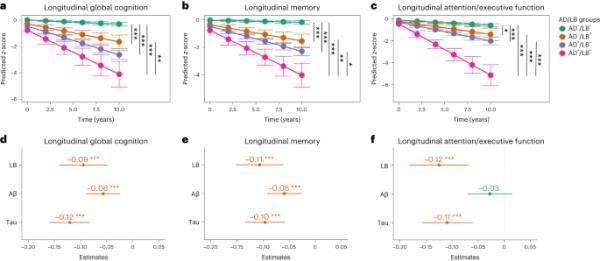
a-c,采用关注AD/LB组×时间相互作用的LME模型检验显著效应(双侧),并根据年龄、性别和教育程度进行调整。a,d,纵向全局认知。b、e、纵向记忆。c,f,纵向注意/执行功能。d-f,相互作用时间×在同一模型中使用所有三种病理(二值化)来检查每种病理对认知进展的独立影响,同时调整年龄,性别和教育程度。结果是z得分认知测试。d-f,红色表示病理与更严重的认知衰退之间存在显著关联。经/不经Aβ和tau调整后,LB对临床结果的影响见扩展数据表3。a-c, AD/LB组从LME模型中获得的估计边际均值和均值的95% CI。d-f,点/中心为时间×病理的相互作用估计;误差柱95% CI。AD - /LB - 941例,AD - /LB+ 74例,AD+/LB - 147例,AD+/LB+ 20例;LB+ 94例,Aβ+ 304例,tau+ 195例。对多个比较进行校正后的统计分析见补充图3(校正后所有显著差异/关联仍然显著)。缺失数据见补充表2。*P < 0.05, **P < 0.01, ***P < 0.001(双面)。
LB病理及向PD或DLB的进展
在所有研究参与者4.46(2.68)年的平均(s.d)随访时间中,无论基线生物标志物状态如何,70人进展为AD, 31人进展为血管性疾病/痴呆,16人进展为DLB, 6人进展为PD(扩展数据表4)。根据基线LB状态分层,进展为DLB或PD的生存分析如图4所示。只有LB+参与者随后发展为DLB或PD。LB+参与者(n = 94)到最后一次就诊或进展为DLB/PD的平均随访时间为3.92(2.61)年,其中23.4%进展为DLB或PD。在那些没有发展为DLB/PD的LB+参与者中(n = 72), 14(19.4%)出现了LB病理相关的症状,如直立性低血压(n = 9),快速眼动(REM)睡眠行为障碍的迹象(n = 3)或帕金森症的迹象(n = 2),而不符合DLB或PD的临床标准。相比之下,嗅觉测试与DLB或PD的临床随访诊断无关,无论是作为生存分析的二元预测因子(P = 0.69)还是作为ROC分析的连续预测因子(AUC 0.64, 95% CI 0.45-0.83)。

当参与者满足PD49或DLB50(或前驱DLB42)的临床标准时,该事件被满足。线条表示生存曲线和阴影区域95% CI的点估计。垂直线表示审查的时间点。下表显示了每个时间点尚未进展为PD/DLB的参与者人数。没有基线时为LB的参与者进展为PD/DLB。根据AD/LB阳性进展到临床诊断的具体情况见扩展数据表4。P值,表明LB+和LB -参与者的生存曲线(即到PD/DLB的时间)有显著差异。
目录
摘要 主要 结果 讨论 方法 数据可用性 代码的可用性 参考文献 致谢 作者信息 道德声明 同行评审 扩展数据 补充信息 搜索 导航 #####讨论
本研究检查并比较了大量认知和神经功能未受损个体中LB、a β和tau病理学的独立临床效果。总的来说,我们发现脑脊液中α-syn SAA检测到的LB病理存在于8%的人群中(图1)。它对横断面(图2)和纵向(图3)认知结果的影响与AD病理相似。嗅觉功能下降与LB病理特别相关,嗅觉测试可以预测LB状态,AUC为0.80(扩展数据图1)。最后,生存分析显示,只有基线时LB+的参与者才会进展到临床诊断为DLB或PD(图4)。
在横断面上(图2g)和纵向上(图3e), LB病理对记忆功能的影响与tau病理的影响程度相似。如前所述,tau对认知未受损个体记忆功能的影响与内侧颞叶早期tau积累有关14,15,16。对于LB病理,它可能更多地与记忆检索有关,而不是编码,正如我们的补充分析所表明的那样,tau而不是LB病理与较差的记忆识别有关(补充表1)。尽管由于样本量较小,这一结果是初步的,但它得到了先前结果的支持17。其他潜在的机制可能是LB病理早期参与内侧颞区18,或者LB病理对多巴胺有负面影响19,而多巴胺对记忆编码很重要20。
Aβ对注意力/执行功能的适度的、孤立的、横断面的影响与最近在认知未受损个体中的结果非常吻合。这种效应可能反映了早期的Aβ积累在对注意力和执行功能重要的区域,这些区域属于默认模式和中央执行网络21。需要注意的是,用PACC测量LB病理对全局认知的影响(图2f和3d), PACC是几个临床前AD试验中用作主要结果的一种测量方法22。在此类阿尔茨海默病试验中,不检测LB阳性可能会妨碍检测抗β或抗tau治疗对认知能力下降的影响,并且可能是导致阿尔茨海默病参与者在大脑中完全去除Aβ后仍持续认知能力下降的几个原因之一23,24。总体而言,我们发现对临床前AD变化敏感的类似认知测量也对LB病理敏感(图3),可能适用于临床前LBD试验。
在本研究中,我们发现13%的Aβ+参与者也是LB+(表1),并且在Aβ阳性(OR 1.72)而不是tau阳性的情况下,LB阳性明显更容易发生。这与基于神经病理学的研究一致,该研究显示,散发性AD25中AD和LB病理明显过度共存。
这种共同发生的潜在机制可能是先前提出的a β对α-syn27的播种效应,以及APOE ε4等位基因不仅驱动AD病理,还与ad28,29中更严重的LB病理相关。此外,在常染色体显性AD和唐氏综合征中,两者都有Aβ的过量产生,LB病理发生的频率比偶然发生的频率更高(LB病理在唐氏综合征患者中患病率为50%,在常染色体显性AD31中患病率为60%,定义为LB病理至少存在于杏仁核)。当解释抗ad治疗对认知未受损的Aβ+个体的影响时,这种共存可能是一个问题,特别是如果LB+参与者在治疗组和安慰剂组之间分布不均。
关于招募临床前LBD的未来试验,LB阳性检测对于确定相关研究人群(例如抗LB治疗)至关重要。我们的研究表明,在健康的中老年人中,LB阳性的患病率相对较低(8%),这与最近使用α-syn SAA的小型研究(3-10%)的结果相似(参考文献)。33、34)。
同时,我们发现进展到临床诊断的DLB或PD仅发生在基线时为LB+的参与者中,支持使用α-syn SAA来识别早期疾病改善治疗试验的临床前LBD,类似于今天如何使用a β和tau生物标志物进行临床前AD试验。然而,在未受损人群中,LB病理学的低患病率表明,需要进行大规模筛查以招募足够大的人群,这使得CSF分析成为一种可行的工具,但不是最佳的工具。筛选过程将受益于使用血液或皮肤活检进行α-syn SAA测试35,36,37,如果它们具有与CSF方法相当的性能。与这种筛选程序相关,我们发现本研究嗅觉测试区分LB+和LB -参与者的AUC为0.80(扩展数据图1)。尽管这对于单独识别LB病理不够准确,但它表明嗅觉测试可能与其他措施相结合,可以用于预筛选程序,以确定适合进行更昂贵和侵入性α-syn SAA测试的个体。我们发现嗅觉测试和LB病理之间的联系得到神经病理学研究的支持,表明偶发性(临床前)LBD与嗅觉受损有关38。这也适用于DLB/PD痴呆病例,以及伴有但不伴有显著LB病理的AD患者39。超过50项研究发现,嗅觉受损是临床诊断为AD40的常见特征,但我们的研究结果表明,这一症状完全是由伴随的LB病理引起的(图2i)。
关于运动功能,无论是基于信息的问卷调查(图1j)还是运动功能量表(UPDRS-III;图2b)。虽然LB病理与有症状个体的运动功能有关,但运动功能可能在一些LBD患者的晚期受到影响,如前驱LBD(即轻度认知障碍(MCI)阶段的DLB和孤立的REM睡眠行为障碍),其中只有大约一半的患者在基底神经节中多巴胺转运体摄取减少,这是单光子发射计算机断层扫描或PET42所显示的。此外,基于信息的运动问卷和UPDRS-III评分都不足以敏感地捕捉到运动功能障碍的早期迹象。未来的研究可能会受益于包括数字评估(例如,可穿戴传感器)和利用双任务范式来检测细微的运动损伤。
在认知能力未受损的个体中,Aβ和tau蛋白阳性已被证明与近期认知进展密切相关13。目前的研究表明,在临床未受损的个体中检测LB病理也具有预后意义,无论是在临床DLB或PD的进展方面(图4),还是在认知能力下降方面(图3)。基于神经病理结果的回顾性分析也支持认知能力下降,例如,与AD或LB病理相比,AD+/LB+个体的注意力/执行功能的快速进展。与目前的研究类似,我们展示了具有两种病理的叠加效应(图3a-c)。总的来说,这表明在A/T/LB框架中,测量LB病理学的存在可能与测量Aβ和tau同样重要。使用这一更新的生物标志物框架可以进一步增加对根据仅使用Aβ和tau病理的传统框架分类的参与者观察到的临床进展异质性的理解45。
本研究有一定的局限性。虽然种群数量很大(n = 1182),但AD+/LB+个体较少(n = 20),与该组相比,检测组间差异的统计能力较低。因此,与该组相比,缺乏统计学上的显著差异应谨慎解释。然而,这并不影响三种病理(n = 94 LB+, n = 304 Aβ+和n = 195 tau+;表1),总体上证实了分组分析(图2f-j和3d-f)。此外,这项研究还缺少数据。也就是说,对所有符合条件的参与者进行分析,而不是对所有认知和非认知测量数据完整的有限样本进行分析。这样做的基本原理是不引入选择偏倚,但这导致数据缺失(详见补充表2和3)。根据研究设计,运动和嗅觉功能的评估仅包括在BioFINDER研究的部分中。尽管如此,在LB病理和嗅觉功能之间发现了显著的关联(图2和扩展数据图1)。为了检查与运动功能缺乏关联是否可能是由于较低的统计功率(II型误差),我们进行了功率分析,结果显示,使用当前的样本(UPDRS数据n = 660),我们能够检测到甚至很小的效应大小(扩展数据图2)。应该指出的是,用于测量这些认知领域的基础认知测试并没有捕捉到该领域的所有方面。因此,重要的关联取决于用于测量特定认知领域的基础测试的类型。由于研究设计,基线Aβ-和tau- pet仅在BioFINDER-2中可用,因此在BioFINDER-1中使用CSF P-tau217和CSF Aβ42/40作为Aβ和tau的生物标志物。然而,这些脑脊液生物标记物与它们的PET对应物显示出非常高的一致性46,47。
总之,本研究表明,使用α-syn SAA测量的LB病理学与认知和神经功能未受损个体的认知表现和嗅觉功能的早期变化有关,并表明近期进展为DLB或PD的风险增加。此外,13%的临床未受损的Aβ+个体也是LB+,与单独的任何一种病理相比,LB和AD病理的共存对认知有额外的有害影响。因此,这些发现可能对临床前阿尔茨海默病药物试验的设计产生影响,其中可以考虑排除LB+个体或确定LB阳性分布在治疗组和安慰剂组之间是相等的。最后,这些结果可以为未来评估药物靶向性的LBD临床前试验的设计提供信息,例如错误折叠的α-syn。
方法
参与者
所有参与者都是BioFINDER-1 (NCT01208675;n = 754)或BioFINDER-2 (NCT03174938;N = 428)先前描述的研究46,51,52。仅纳入具有完整的a β、tau和α-syn数据集,并且在基线时认知和神经功能未受损的参与者。认知未受损的分类是根据国家老年研究所-阿尔茨海默氏症协会的标准定义的,即不符合轻度认知损伤或痴呆的标准。认知未受损的参与者包括认知健康的对照组(n = 853)和主观认知能力下降的参与者(n = 329),他们在大型认知测试中表现在正常范围内(即没有轻度认知障碍)。详细的研究标准先前已发表46,52,53。简而言之,参与者年龄在40-100岁之间,在最小精神状态检查(MMSE)中得分≥24分,并且能够说和理解瑞典语,不需要翻译。纳入的参与者在基线时均未达到PD54或前驱DLB42的临床标准。所有患者入组并在2007年至2015年(BioFINDER-1)或2017年至2021年(BioFINDER-2)期间接受基线检查。MCI的排除标准定义为表现低于- 1.5 s.d。在至少一个认知领域记忆,注意/执行,语言或视觉空间功能。在BioFINDER-1中,这是由一位资深神经心理学家在经过彻底的神经心理学测试后评估的,如前所述55。在BioFINDER-2中,根据a β阴性对照中基于年龄和教育程度的回归规范,MCI分类在任何认知领域的表现都低于- 1.5 z分数56(见参考文献)。57,58对基于回归的z分数的描述)。认知领域z分数是通过计算以下每个领域测试的平均z分数得出的:注意/执行功能(轨迹制造测试A、轨迹制造测试B和符号数字模态测试(SDMT))、语言能力(语言流畅性动物和15字短版波士顿命名测试)、记忆(阿尔茨海默病评估量表(ADAS)中的10字延迟回忆)和视觉空间(来自视觉对象和空间感知测试的不完整字母和立方体分析)功能。主观认知能力下降的参与者有轻微的认知症状(被参与者或被告知者感知),但不符合轻度认知障碍的标准。
所有参与者均提供书面知情同意书。伦理批准是由瑞典隆德地区伦理委员会给予的。
临床结果
除嗅觉测试外,所有临床结果均根据Aβ -认知未受损受试者在BioFINDER-1和-2中的分布进行z评分,嗅觉测试使用LB -认知未受损受试者在BioFINDER-1和-2中进行归一化。改良的临床前阿尔茨海默氏认知复合-5 (mPACC5,也称为PACC)被用作全球认知的衡量标准,包括记忆、执行、注意力和语言功能的测试59。它是基于先前描述的PACC5,使用MMSE、SDMT和动物fluency59计算出来的。由于BioFINDER中没有记忆测试、逻辑记忆测试和自由提示选择性提醒测试,因此使用了adas -认知(ADAScog)60中的10字延迟回忆任务(加权两次),正如之前在几个研究中应用的那样61,62。因此,mPACC5使用基于Aβ -认知未受损分布的z分数计算,计算方法如下:(MMSE + (ADAScog延迟回忆× 2) + SDMT +动物流畅性)/5。
使用ADAScog60中的十个单词延迟回忆任务来测量记忆。注意/执行功能使用SDMT63进行测量,如果无法使用SDMT63,则使用MMSE的串行7s任务(见补充表2和3中缺失的部分)64。
嗅觉功能在BioFINDER-1中使用简短的嗅觉识别测试(Sensonics International)65,在BioFINDER-2中使用非常相似的ODOFIN Burghart嗅探棒(MediSense)66进行评估。为了解释最大得分(分别为16分和12分)的差异,根据每个队列中LB参与者的分布分别对结果进行z评分。
运动功能是通过基于信息的认知障碍问卷(CIMP-QUEST)67的运动部分的总分来测量的,该问卷评估了运动迟缓、行走方式改变、平衡能力下降、手笨拙、震颤、面部表情改变和构音障碍等。在补充分析中(扩展数据图2),使用UPDRS-III测量运动功能(参考文献68)。UPDRS-III由三名注册物理治疗师执行和评定。
Aβ生物标志物
如前所述,a β阳性被确定为具有异常的[18 F]-氟替他莫PET,使用在新皮质复合区测量的0.53标准摄取值比(SUVR)的预定义截止值,使用脑桥作为参考区域,如前所述46。由于研究设计,在BioFINDER-1中未将a β- pet纳入基线,因此,如前所述,使用预定义的CSF a β42/ a β40比值临界值<0.066来定义异常53。a β42和a β40在Cobase 601分析仪上使用罗氏NeuroToolKit进行分析。
脑脊液和PET的截止时间之前已经使用混合模型统计建立了69,并且两种模式显示出非常高的一致性70。
tau生物标志物
Tau阳性定义为CSF P-tau217 (BioFINDER-1)异常或Tau - pet (BioFINDER-2)异常。CSF P-tau217采用Eli Lilly开发的Meso Scale Discovery平台进行检测,tau-PET采用RO948标记放射性氟[18 F]进行检测,如前所述46。SUVR在感兴趣的颞元区域(ROI)测量,使用小脑下皮层作为参考区46。截止时间设定在平均+ 2 s.d。如前所述,a β阴性对照;CSF P-tau217的临界值>11.42 pg ml-1, tau-PET的临界值>1.32 SUVR(参考文献46)。
重组α-synuclein的制备(LB病理)
重组野生型α-syn的纯化如先前报道的那样进行,并进行了少量修改。简单地说,从甘油高液中转化的大肠杆菌BL21 (DE3)细菌(New England Biolabs)在含有卡那霉素(Kan+, 50µg ml-1, Sigma)的选择板上划线,并在37°C下孵育过夜。选择一个菌落,接种于加卡那霉素的5 ml Luria肉汤(LB, Sigma)中,37℃连续搅拌,250 rpm,培养4-5 h。然后将该发酵剂添加到1l含有卡那霉素的LB和隔夜快速自诱导系统(默克-密理孔,no。71300-4)在一个完全密封的烧瓶中。细胞在37°C, 200 rpm的振动培养箱中培养过夜。第二天,将培养物分成4个250 ml的烧瓶,在4°C下,3200g离心10分钟。用血清学移液管将微球轻轻重悬于25 ml含有40%蔗糖(Sigma)、2mm EDTA (Sigma)和30 mM Tris (Bio-Rad)的渗透冲击缓冲液中,缓冲液pH为7.2,室温下在旋转混合器上轻度搅拌10分钟。然后将溶液在9000 g, 20 s下离心20 min,加入20µl饱和MgCl2 (Sigma)。在冰上轻微摇晃3分钟后,将悬浮液在4°C下9000 g离心30分钟,将上清收集到100 ml的玻璃烧杯中。加入400-600µl HCl 1 M (PanReac AppliChem)将pH降至3.5,在室温下搅拌10分钟。在4°C下9000 g离心30分钟后,上清收集到一个干净的100 ml玻璃烧杯中。通过加入400-600µl NaOH 1m (Sigma)将pH调节至7.5。蛋白提取物经0.22µm过滤器(Merk-Millipore)过滤后,装入Ni-NTA柱(Cytiva, no. 6)。17525501)在NGC色谱系统(Bio-Rad)上,并在室温下用20 mM Tris pH 7.5洗涤。柱进一步用50 mM咪唑(Sigma)在Tris 20 mM pH 7.5中洗涤,产生一个未收集的峰。在20 mM Tris pH 7.5中线性梯度至500 mM咪唑,并在30 - 75%咪唑缓冲液(分别为150和375 mM)之间收集峰。该峰被加载到Q-HP阴离子交换柱(Cytiva, no。17115401),在Tris 20 mM pH 7.5中洗涤,然后在Tris 20 mM pH 7.5中用100 mM NaCl洗涤。同样,在Tris 20 mM pH 7.5中,线性梯度至500 mM NaCl,以收集300至350 mM NaCl之间的峰。将这些馏分混合,通过0.22µm过滤器过滤,并使用3.5 kDa的MWCO透析膜(thermoscientific)在4°C下对milliq水进行透析过夜。第二天,将蛋白移入新鲜的milliq水中,再透析4小时。用分光光度法测定蛋白质浓度,理论消光系数为0.36 (mg ml-1) -1 cm-1。最后,将蛋白冻干6小时,分罐保存,最终浓度为1 mg ml-1,再悬浮于500µl磷酸盐缓冲液(PB, 40 mM, pH 8.0, Sigma)中。冻干后的等分液保存在- 80°C直到使用。
α-Syn RT-QuIC分析
α-Syn RT-QuIC分析对受试者的临床状态和诊断进行盲法分析,并根据既定方案9,10,71进行轻微修改。简单地说,每口井将6个0.8 mm硅珠(OPS Diagnostics)预装到黑色、透明底、96孔板(Nalgene Nunc International)中。脑脊液样品在使用前解冻并旋转10s。将15微升CSF加入到85 μl的反应混合物中,该反应混合物由40 mM PB pH 8.0、170 mM NaCl、10 mM硫黄素- t (Sigma)、0.0015% SDS (Bio-Rad)和0.1 g l-1过滤的重组α-syn (100 kDa Amicon离心过滤器,默克Millipore)组成。用封板膜(Nalgene Nunc International)封闭板,在42°C下放入Fluostar Omega板读卡器(BMG Labtech)中孵育,400 rpm下间歇双轨道振动1分钟,然后休息1分钟。在30小时的测试中,每45分钟用450 nm激发和480 nm发射滤光片测量一次荧光。样本和对照组一组四次,当四次重复中至少有三次达到任意设定的阈值,即阳性对照重复达到的Imax值中位数的30%时,第一次运行后视为阳性。为了将假阳性结果的风险降到最低,我们重复了三次样品分析,在第一次运行中,四次重复中只有一两次显示播种活性。只有当12个重复中至少有4个达到阈值时,我们才认为结果为阳性。在整个研究过程中,我们使用了30个不同批次的α-syn重组蛋白,每个批次在使用前都进行了质量控制测试。我们在每个平板上至少做了一个阳性对照和一个阴性对照。阳性对照从可能或明确的DLB或PD患者中选择,其脑脊液样本在筛选过程中产生4 / 4的阳性重复。在最终分析的每个验证实验(平板)中,阳性对照/s显示4个阳性重复中至少有3个。
磁资源娘娘腔的成像
如前所述,参与者使用BioFINDER-1中的西门子3t Trio扫描仪(西门子医疗解决方案)和BioFINDER-2中的西门子3t MAGNETOM Prisma扫描仪(西门子医疗解决方案)进行检查21,46。使用FreeSurfer (v6.0, https://surfer.nmr.mgh.harvard.edu)对T1图像进行体积分割和分割。以下区域用于组比较(AD/LB)和Aβ、tau和LB病理的独立影响:杏仁核(左、右体积);海马体(左右体积);内侧颞叶(左、右内嗅、梭状回和海马旁皮质厚度);颞外侧(颞上沟左右岸、颞下、颞中、颞上、颞极和颞皮层横向厚度);内侧顶叶(中央旁、峡扣带、后扣带和楔前叶皮质厚度);侧顶叶(中央后、下顶叶、上顶叶和边缘上皮质厚度);枕部(楔骨、枕骨外侧、舌部和牙周皮质厚度);和额叶(剩余的皮质自由冲浪区)区域。在构建复合区域时,除杏仁核和海马体外,其余均为表面加权。根据年龄、性别和磁共振相机(以及海马和杏仁核体积的情况下的总颅内体积)对分析进行了调整。
此外,所有t1加权图像都使用基于体素的形态测量法在统计参数映射软件(SPM12;http://k1.fpubli.cc/file/upload/202308/21/mmpfm1wtk25。首先,将图像分割为灰质、白质和脑脊液。然后,我们使用微分同构非线性图像配准工具46基于整个样本的灰质和白质组织创建研究特定模板。一旦模板被创建,灰质组织就会使用由配准产生的单个流场被扭曲到蒙特利尔神经学研究所的空间中,并且体素值会因归一化引入的体积变化而被调制。最后用全宽为12 mm的各向同性高斯核对图像进行平滑处理。为了在统计分析中考虑头部大小的差异,我们计算了每个受试者的总颅内体积,即灰质、白质和脑脊液体积的总和。除了使用上述基于freesurfer的roi进行分析外,我们还在控制年龄、性别、颅内容积和磁共振相机等因素的情况下,使用分组作为四个水平(AD - LB -、AD - LB+、AD+/LB -、AD+LB+)的平滑灰质图像的方差分析进行了体素比较。采用家庭误差率校正集(P < 0.05)对所有结果进行多重比较校正。
统计分析
在横断面分析中,AD/LB组、年龄、性别(指定的,非自我报告的)以及认知测试结果、受教育年限被用作一般线性回归模型中的自变量。当使用UPDRS-III作为结果时,模型也根据UPDRS-III评分进行调整(总共三个评分)。因变量是认知、嗅觉或运动功能。接下来,使用二值化的Aβ、tau和LB病理(以便更容易比较估计)代替AD/LB组。所有三种病理与年龄、性别和受教育年限(运动功能模型不包括受教育程度)一起用于同一模型。在纵向分析中,使用LME模型(R包lme4和lmerTest)。认知功能作为结果,AD/LB组×时间和病理×时间的相互作用有显著结果。模型还包括年龄、性别、受教育年限以及随机斜率和截距。对于包含病理×时间的模型,还包括时间与所有协变量之间的相互作用。在敏感性分析中,使用AD/LB组×时间的LME模型也对基线认知测试结果进行了调整,并将认知测试结果与基线的变化作为结果(用于存在认知基线组差异的比较)。所有可用资料均用于统计分析。在补充表2和3中描述了每次访问的缺失数据和参与者人数。双侧P < 0.05为差异有统计学意义。采用α = 0.05的错误发现率方法进行多次比较校正,对每个结果进行校正(即AD/LB组比较有6个比较,LB、Aβ和tau病理的独立影响有3个比较)。线性回归模型的功率计算使用R软件包WebPower(80%功率,α = 0.05)。采用R v.4.1进行统计分析。
报告总结
有关研究设计的更多信息可在本文链接的自然组合报告摘要中获得。
下载原文档:https://link.springer.com/content/pdf/10.1038/s41591-023-02450-0.pdf

