摘要
实时定量PCR (qPCR)校准曲线具有高重复性,可生成特异性、敏感性和可重复性的数据,可用于基因定量。然而,严格验证qPCR中的外部校准曲线模型是很重要的,因为绝对定量取决于所使用的标准。我们提出了一种基于qpcr的标准化方法,使用质粒DNA (pDNA)校准器对主要鱼类过敏原Lophius piscatorius β-小白蛋白(β-pvalb)基因进行定量分析。在平行实验中,将从鱼腥鱼l.s icatorius分离的基因组DNA (gDNA)与携带靶标pvalb的基因组DNA (pDNA)生成标准曲线并进行比较。采用TaqMan qPCR技术,以鱼腥鱼pvalb基因的第二个内含子为靶点,对pDNA和gDNA校准器用于β-pvalb定量的可交换性进行了评价。用pDNA代替gDNA校准剂,观察到更高的PCR效率、良好的线性和更低的标准偏差(sd值)。pDNA校正剂在接近未知样品的期望值方面比其基因组对应物表现出较低的偏差。该方法特异性强,灵敏度高,检测限(LOD)和定量限(LOQ)分别为5份和10份。pDNA校准剂的短期稳定性研究表明,其在- 20°C下的稳定性为60天,在4°C下的稳定性为30天。高效的结果表明,质粒校准器是pvalb基因绝对定量的潜在工具,也是传统gDNA标准的替代品。
介绍
定量PCR是目前核酸定量的金标准。有各种基于PCR的定量方法,如qPCR、竞争性PCR和数字PCR。qPCR是目前最精确、应用最广泛的基因定量方法[1]。它用于鉴定、定量和重组DNA(质粒DNA)分析,涵盖许多医学和食品安全应用。在qPCR中,基本原理是通过合成扩增双链DNA (dsDNA)时发出的荧光水平来计算DNA扩增量。qPCR虽然简单,但要实现可靠的定量,还存在一些具体问题,如标准品的选择[2]。本研究构建了一种基于质粒DNA (pDNA)的校准器,用于琵琶鱼β-pvalb基因的绝对定量。
小蛋白是钙调蛋白家族中的热稳定蛋白,主要存在于脊椎动物的肌肉组织中。一种具有高Ca2+结合亲和力的小酸性蛋白,包含108-109个氨基酸残基,分子量为12 kDa,是人类主要的鱼类过敏蛋白[3,4]。防止掺假是人们普遍接受的开发检测工具的原因,这些工具绕过了加工鱼肉后缺乏形态特征的问题。人们很少意识到,但同样重要的是,与食物健康有关的因素,因为对一些消费者来说,食用鱼肉会引发过敏反应。这种反应的规模可以从轻微的症状开始,但在极端情况下,它可以达到危及生命的严重情况。尽管这些易受影响的消费者对鱼类本身具有普遍的反应性[5,6,7,8],但在某些个体中,他们的反应仅限于某些鱼类[7,9,10,11]。正因为如此,对加工过的鱼肉进行适当的定性和定量测定对公共卫生起着重要作用。
使用标准曲线法的绝对定量qPCR是环境和食品微生物学中应用最广泛的技术[12,13,14]。标准曲线可以通过放大已知浓度的标准模板的连续稀释度来构建,然后对标准模板的DNA浓度的对数与阈值周期(Ct)进行线性回归。该方法假设样品的效率和标准相同[2,14,15]。在实践中,效率可能不相似,影响准确性。为了克服效率波动,标准稀释液和未知样品通过相同的方案使用相同的放大特性进行放大[16]。因此,标准曲线的信度和效度非常重要[17]。它还取决于设计和制造的标准控制、测量的精确浓度和较长的保质期[18,19]。
标准对照或校准器可以使用纯化的PCR扩增子,质粒,基因组,cDNA或合成寡核苷酸构建。重组pDNA和基因组DNA (gDNA)一起克隆,由于其高稳定性,可以产生可重复的标准曲线[19,20,21]。由于各种研究支持使用质粒标准曲线进行绝对qPCR定量,我们也比较了pDNA和gDNA标准。质粒校准剂的优点是相对容易构建,在冷冻时可以长时间保持稳定,并且可以在更广泛的工作范围内大量生产、放大和纯化[21]。
基于dna的校准曲线的一个问题是,它们只经过PCR步骤,不像转录研究中的未知mRNA样本,必须首先逆转录。这增加了qPCR结果变异性的可能性,并且扩增结果可能无法准确地与未知样本的结果进行比较[17,18]。质粒1替代gDNA提取物完全解决了这些技术挑战[22,23,24]。一段DNA,比如源自端点PCR的扩增子,可以克隆到细菌载体中。在酶连接酶的作用下,质粒载体的初始线性分子通过与该DNA片段的采用和共价键连接而循环[25]。所得到的克隆主要是通过抗生素耐药性进行筛选,并仅使用蓝白选择方法筛选携带插入片段的克隆[26]。
为了找到定量PCR中由gDNA制成的标准曲线的替代方法,需要同时使用基因组和克隆质粒DNA进行实验[27]。本研究的目的是确认重组校准器可用于未来复杂样品中某些鱼类的浓度或分数的质粒评估,减少对特定鱼类gDNA的依赖,并在全球范围内标准化定量能力。
本文将L. piscatorius pvalb基因蛋白编码部分的第二内含子区成功克隆到细菌质粒载体pGEM-T Easy pvalb中,并以此作为pvalb的定量标准。将所构建的pDNA与鱼腥味乳杆菌的gDNA进行比较,作为绝对qPCR检测的标准。我们还研究了质粒标准品相对于gDNA标准品的短期稳定性,为qPCR提供了一种工具,其中质粒校准器可以替代传统使用的gDNA检测。
材料与方法
样品采集和制备
从捷克共和国布拉格当地渔场和食品店采集了鱼形拟乳杆菌(Lophiiformes, Lophiidae)的鱼类样本。根据标签进行了分类鉴定,并由查尔斯大学理学院的鱼类学家进行了确认。鱼组织保存在- 20°C的50 ml管中,用于进一步的下游应用。
DNA的分离和定量
在提取之前,鱼组织被解冻并使用研钵均匀化。使用NucleoSpin®Tissue试剂盒(MACHEREY-NAGEL GmbH & Co. KG, d
益生元核苷酸引物
针对L. piscatorius β-pvalb第二内含子的引物对采用Mukherjee等人的定义[28]。引物对用于扩增目标区域。纯化阳性扩增子并测序(SeqMe, Dobříš,捷克共和国)。获得的序列在BioEdit Sequence Alignment Editor, version 7.0.9.0 (California, USA)中进行可视化和处理,并用于设计探针(软件Primer3Plus, Boston, USA)(图1)[29]。Taqman qPCR试验中使用的引物(DAS F和DAS R)和探针(DAS_Probe1)如表1所示。引物和探针(表1)由Generi Biotech (Hradec Kralove, Czech Republic)合成。
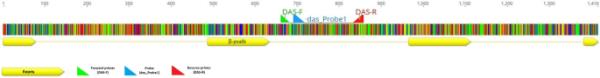
鱼乳杆菌β-pvalb基因引物和探针的定位[30]
有限公司目标质粒载体的构建
设计引物DAS F和DAS R克隆到细菌质粒载体pGEM-T Easy vector System,全长3.2 kb (Promega, Wisconsin, USA),携带L. piscatorius特异性pvalb基因第2内含子靶区(196 bp)。
PCR扩增的热循环条件为95°C, 5 min, 94°C, 30 s, 40个循环;60℃,40 s;在Veriti™热循环器(Applied Biosystems, California, USA)中进行72°C, 60秒和72°C, 7分钟的最终延长。PCR产物通过琼脂糖凝胶电泳分析,并使用PCR产物纯化试剂盒(Qiagen GmbH, Hilden, Germany)进行纯化。PCR扩增子浓度由NanoDrop(德国m
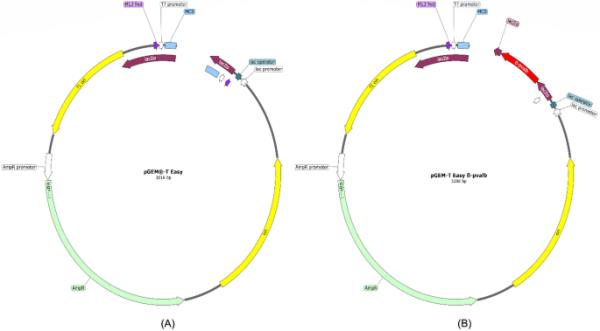
携带pvalb靶基因的pGEM®-T Easy质粒转化为B pGEM®-T Easy β-pvalb (3.2 kb)的遗传图谱
基因组DNA和质粒标准品的制备
从鱼腥鱼l.s atorius组织中提取基因组DNA,制备五步连续稀释作为标准品,拷贝数为105-101。不使用载体DNA制备gDNA标准品。
使用克隆内含子片段的线性化质粒pGEM-T Easy pvalb (196 bp,图2)制备五步连续稀释作为标准,拷贝数范围为105至101。
拷贝数根据L. piscatorius基因组大小gDNA为747.36 Mb, pDNA为3.2 kb计算,计算公式如下(1),由Lee等人提出[13]。
(1)用标准品构建标准曲线,比较gDNA和pDNA的PCR效率、线性和回归系数。结果用于建立和验证基于质粒的qPCR绝对定量鱼腥鱼乳杆菌校准器。
qPCR
使用StepOne plus™qPCR系统(Applied Biosystems, California, USA)通过TaqMan assay (Applied Biosystems, California, USA)对DNA进行定量,所用引物和探针见表1。采用StepOne软件V2.3 (Applied Biosystems, California, USA)设计实验并分析实验数据。
反应混合物含有10 μl 2 × TaqMan™Universal Master mix 2和UNG(尿嘧啶- n -糖基化酶)(Life Technologies, California, USA),其中含有ROX参比染料(5-羧基- x罗丹明的甘氨酸偶联物,琥珀酰亚胺酯)作为被动参比染料,引物(表1)终浓度为0.4 mmol/l。0.1 mmol/l探针(表2),模板DNA (gDNA和pDNA)和无核酸酶水2µl,总反应体积为20 μl。使用以下热循环模式:在50°C下初始保持2分钟,在95°C下初始变性和聚合酶激活10分钟,在95°C下变性15秒,在60°C下退火1分钟,35个循环。所有PCR反应在三个平行中进行三次。
检测限(LOD)和定量限(LOQ)的确定
定量限(LOD)和定量限(LOQ)是qPCR检测中最重要的参数,指的是能够可靠地检测和定量的目标物的最低数量,其概率≥95%[32,33]。定量限和定量限都是分析化学中必不可少的参数,用来决定分析方法和仪器的灵敏度和精密度。绝对限制是可以检测和量化的初始模板副本的最低数量。TaqMan qPCR的绝对定量限和定量限分别用连续稀释的pDNA和gDNA测定。所有PCR运行均按上述循环参数进行评估。
短期稳定性研究
L. piscatorius gDNA和pGEM-T Easy pvalb pDNA稳定性研究的实验设计基于先前报道的质粒校准器稳定性研究[26]。线性化pGEM-T Easy pvalb pDNA和gDNA标准品各系列稀释3管,分别保存在4°C和- 20°C。分别在0、15、30和60天后取出等量的gDNA和pDNA标准品,并按上述方法进行评估。进行PCR效率、回归系数和3个平行检验。
统计分析
采用单因素方差分析(ANOVA)对pDNA和gDNA校准剂连续稀释后的qPCR方法的PCR效率和相应回归线的线性进行比较和统计分析。使用Microsoft Excel软件(Analysis ToolPack for Microsoft Excel 2020)进行统计检验。
目录
摘要 介绍 材料与方法 结果与讨论 结论 数据可用性 参考文献 致谢 作者信息 道德声明 搜索 导航 #####结果与讨论
在目前的工作中,我们成功地使用了一种基于质粒的(pGEM-T Easy pvalb)校准器,用于对L. piscatorius pvalb的第二个内含子β-pvalb基因进行绝对定量。我们用它作为模型生物。使用NucleoSpin®tissue试剂盒提取L. piscatorius组织中的DNA。纳米滴定量为412±6µg/µl。引物组(DAS F和DAS R)是为Lophius样品的gDNA扩增而设计的。
有限公司构建pGEM-T Easypvalb质粒
构建质粒pGEM-T Easy pvalb的过程是将L. piscatorius β-pvalb基因第二个内含子的196 bp片段插入到pGEM-T Easy载体中(图2)。这导致质粒pGEM-T Easy pvalb的形成,如图2B所示。pGEM-T Easy pvalb的DNA序列证实含有196 bp的pvalb序列。
qPCR
针对质粒DNA中pvalb基因的第二个内含子的TaqMan qPCR检测构成了本研究的基础。TaqMan法分别检测gDNA和pDNA。用5倍稀释得到标准曲线,每次反应105 - 101份gDNA和pDNA。将CT值与两种校准剂的拷贝数的对数绘制(图3)。对包含校准曲线的每个数据集应用简单线性回归(最小二乘分析),以给出容纳所有数据点的最佳拟合直线。采用多参数方法比较pDNA和gDNA系统标定曲线的相关系数(R2)和PCR效率。
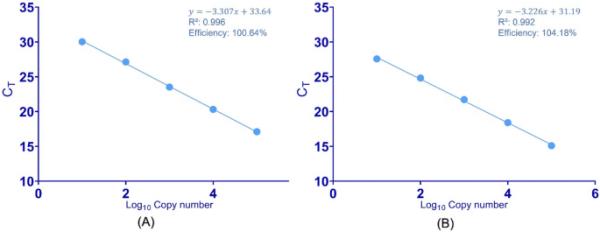
以β-pvalb基因第二内含子为靶点的鱼乳杆菌qPCR标准曲线。提取的pDNA 5倍稀释系列(pGEM-T Easy pvalb)的qPCR得到标准曲线;通过连续稀释gDNA得到的qPCR标准曲线
两种校正剂PCR效率的比较
PCR效率是衡量在给定运行中大多数PCR循环接近完美复制产物的程度,是确定测定可靠性和性能的最重要参数之一[2]。高效qPCR的效率接近100%;但是,如果效率低,则可能导致定量不准确,因为起始模板与扩增产物之间的关系是非线性的。pDNA和gDNA的平均扩增效率分别为100.64%和104.18%。三个平行试验进行了三次,单因素方差分析显示单个校准剂之间没有显著的统计学差异(表2)。根据MIQE指南,结果在90-110%的最佳效率可接受范围内。相关系数R2(可接受平均值)≥0.98,表明实验数据与回归线的拟合程度。gDNA标准曲线与pDNA标准曲线的R2值(R2 = 0.992)差异无统计学意义(R2 = 0.996)。结果表明,两种标准曲线均具有合理的效率、良好的线性度、灵敏度和准确度,适合作为pvalb定量的标定剂。然而,正如预期的那样,pDNA PCR效率显著优于gDNA校准器效率(p = 0.01)。Pvalb是鱼类产品中发现的重要过敏原,是定量分析的重要基因靶标。由于PCR扩增的指数性质,PCR效率的微小差异会导致拷贝数估计的显著差异[34]。这对食物中过敏原的定量测定具有重要意义。由于扩增DNA的量与样品中存在的过敏原的量成正比,较低的效率可能导致不准确的定量,从而不符合有关过敏原标签的规定。因此,效率为100.64%的pDNA比gDNA更适合于定量。
使用pDNA和gDNA标准的qPCR检测的重复性和再现性
采用线性化pGEM-T Easy pvalb pDNA和L. piscatorius gDNA作为校准剂,对qPCR检测的重复性和再现性进行了检验。如表3所示,结果表明该方法具有良好的重复性,SD值和偏置值均低于25%,且在ENGL可接受范围内[35]。结果表明,pDNA校正剂在计算β-pvalb的实验拷贝数方面优于gDNA校正剂。因此,采用pGEM-T Easy pvalb校准器的qPCR检测是可靠的,适用于定量pvalb,其性能可与gDNA校准器相媲美。
定量结果的准确性被评价为观察到的拷贝数和实现值之间的偏差。以RSD评价该方法的精密度。质粒校正剂的RSD和偏置值(图4)均在< 25%的可接受范围内[35]。gDNA校准剂的RSD和偏置值较高。本研究获得的RSD和偏倚值与先前报道的RSD和偏倚值相似[36,37,38],表明校准剂的选择会影响分析的可靠性和准确性。本研究结果表明,构建的pGEM-T Easy pvalb定量β-pvalb是可靠可信的。我们的结果表明,gDNA校准器倾向于低估pvalb的含量。使用gDNA校准剂对样品的低估可能是由于与pDNA校准剂相比,gDNA校准剂的PCR效率较低(表2)。与基因组校准剂相比,pDNA校准剂在接近预期值方面表现出更好的性能特征(图4)。这与报道的用于定量食物过敏原的单目标和多目标质粒校准剂相关的优越性能特征相一致[38]。
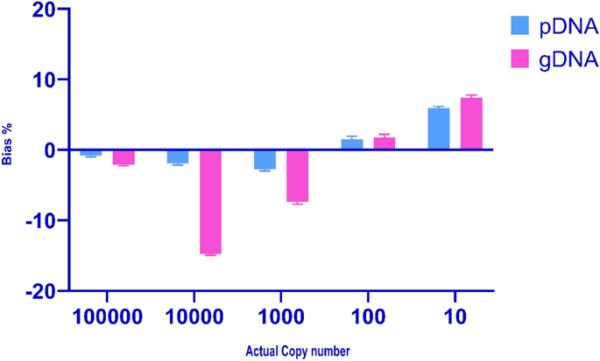
观测值与真值/赋值之间的偏差
检测限(LOD)和定量限(LOQ)的确定
定量限(LOD)和定量限(LOQ)定义为qPCR检测中能够检测和定量的目标基因的最低数量,其概率大于95%。质粒pGEM-T Easy pvalb的定量限和定量限分别为100、50、25、10和5拷贝/μL。根据ENGL [35], LOD和LOQ的验收标准应分别小于25份和50份。结果表明,pGEM-T Easy pvalb的LOD和LOQ分别为5拷贝和10拷贝/反应,L. piscatorius gDNA的LOD和LOQ分别为10拷贝和25拷贝/反应。pGEM-T Easy pvalb和gDNA均可在9次重复反应中检测到7次。LOD和LOQ对于评估分析方法和仪器的性能以及确保数据可靠和准确至关重要。在许多领域,包括环境分析、食品安全和药品,监管机构为分析方法设定了最低LOD和LOQ要求,以确保结果准确和有意义[38]。该检测方法的高灵敏度表明,它适用于定量致敏蛋白,即使是少量的,这对于检测加工食品中的微量过敏原和满足目前的全球标签立法是重要的。
pGEM-T Easy的短期稳定性研究pvalb
检测pDNA和gDNA标准品在4°C和- 20°C保存60天的稳定性,在第0、15、30和60天进行标准曲线构建,比较PCR效率。质粒DNA pGEM-T Easy pvalb在60天内的PCR效率优于gDNA校准物(图5)。pDNA在−20℃条件下的PCR效率在60天内可接受范围内,而在4℃条件下的PCR效率在30天内可接受范围内。同样,gDNA标准品在- 20°C下也能稳定60天,但效率低于pDNA标准品。此外,在4°C时,标准品显示出部分降解,PCR效率超过110%。
.jpg)
A质粒DNA标准品独立实验的PCR效率不同储存时间后的B基因组DNA标准
pDNA可以方便地储存在- 20°C,并在冷包或干冰中运输到世界各地。虽然DNA在储存和运输过程中会发生降解,但理想的参考物质应该能够抵抗损失和降解。相关系数(R2)呈线性回归,在−20°C条件下观察60天,相关系数≥0.99,无统计学差异,表明该指标稳定,无稀释误差。结果还表明,PCR法仍然可以检测和量化大量的pvalb,即使在储存很长一段时间后。这一点很重要,因为它表明,即使在相当长的时间过去后,样品的保存方式也允许PCR产生可靠的结果。这在样品需要在分析前长时间保存的情况下特别有用,因为它表明样品可以可靠地保存并在以后用于PCR分析。这些结果也与先前报道的研究一致[16]。结果证实,质粒标准物质可以保存60天,增加了目前对质粒校准剂稳定性的了解。此外,虽然我们使用了线性化的pDNA,但由于非线性质粒的高稳定性,它们也可以在- 20°C下使用14天[39]。
实时qPCR的出现极大地提高了分子生物标志物在诊断和监测人类疾病、定量测定转基因成分和微生物群落分析方面的应用[14,40,41]。使用qPCR方案可能在定量潜在过敏原方面提供优势,尽管需要进一步评估以得出明确的结论。鱼类通常同时含有α-和β-pvalb,大多数物种表达多个β-pvalb亚型,氨基酸组成和序列存在显著差异[37,42,43,44]。这种异质性增加了鱼类过敏诊断和过敏性小白蛋白检测的复杂性,因为个体对一种β-pvalb亚型的反应可能比另一种更强烈[37]。因此,我们的实验是针对β-pvalb基因的,因为它具有致敏性。
qPCR具有可靠性高、灵敏度高、重现性好、起始物料用量少、定量动态范围大、成本相对较低、分析时间短等优点,已成为广泛应用的热门方法[16,45]。
绝对量化和相对量化是两种量化策略,各有优缺点。绝对法通过将Ct值与标准曲线关联来定量目的基因的浓度,而相对法则使用含有内参基因的参比样本进行定量[46]。使用参考样本的一个显著缺点是它们不能在全球范围内标准化,导致实验室之间的结果存在差异。因此,需要努力在实验室之间建立标准化的生物分子校准器方法。在免疫诊断中经常出现这种情况,其中一些蛋白质分子作为校准物起标准物的作用[47]。尽管基于DNA的诊断和检测是在首次尝试引入一些实验室间标准时进行的,但世卫组织于2016年宣布了确定爱泼斯坦-巴尔病毒的国际标准[48]。尽管在特定实验室内使用病毒的克隆片段作为替代校准器之一,但eb病毒的全基因组DNA被用作国际标准。关于实验室之间的差异规模,在eb病毒载量测定的背景下,在这些检测中,实验室之间的差异超过两个数量级似乎是常见的[48]。为了规避这些限制,使用质粒校准器进行定量。虽然质粒的构建可能很耗时,但一旦构建就可以直接复制。正如我们的数据所强调的那样,质粒DNA可以产生高度可重复的标准曲线,并且在长达60天的存储中具有很高的稳定性。因此,pDNA很容易在全球范围内分发,标准化参考材料。
本方法通过引入质粒标准,规范了pcr法检测鱼腥味乳杆菌的方法。它提供了一个不可避免的帮助,以取代基于DNA分离的校准器从一个特定的标本与质粒之一。单个实验之间获得值的变异、SD和RSD在一个数量级内,这在其他基于dna的定性分析中实验间差异的背景下是令人满意的。在本研究中,我们演示了利用质粒校准器将目标克隆到质粒(pGEM-T Easy pvalb)中来定量鱼乳杆菌的pvalb基因。我们还比较了基因组和质粒的标准曲线,证明了质粒标准在60天内的稳定性。
下载原文档:https://link.springer.com/content/pdf/10.1007/s00217-023-04357-z.pdf

