摘要
本研究建立并验证了脱氢乙酸、苯甲酸、山梨酸、对羟基苯甲酸甲酯和对羟基苯甲酸乙酯等防腐剂的测定方法。采用溶剂萃取法和高效液相色谱法测定防腐剂含量。该方法成功地应用于果酱、奶酪、酱油等食品样品中防腐剂的测定,具有较高的准确度(回收率在87.8% ~ 110%之间)和精密度(日内、日间RSD分别小于5.92%和7.72%)。为验证改进检测方法的适用性,选取13个食品项目,采集521个样品进行监测。结果,所有病例都符合韩国标准。因此,本研究可望对国内流通食品和进口食品的防腐剂安全管理有所贡献。
介绍
防腐剂是指防止微生物生长引起食品变质的食品添加剂。在韩国,用于食品保鲜的常用防腐剂包括脱氢乙酸、山梨酸、苯甲酸、对氧苯甲酸酯、丙酸及其盐类(MFDS, 2020)。国际上对防腐剂的规定从使用条件、可使用的食品种类和最大使用量等方面进行了精确的规定(Guarino et al., 2011)。各国对商业防腐剂的发展趋势各不相同。此外,由于防腐剂不符合国内食品法规的标准,可以合法使用的可能无法进口,分销或销售(Shin, 2016)。因此,通过准确的防腐剂检验过程进行管理是至关重要的。为了遵守即将出台的法规和有效控制食品安全,需要一种快速可靠的方法来确定食品防腐剂。对食品样品中山梨酸和苯甲酸的测定进行了一些研究。许多分析方法,包括高效液相色谱法(Phechkrajang and Yooyong, 2017;Jang et al., 2018;Timofeeva et al. 2019)和气相色谱(GC) (Park et al., 2016;丁等人,2018;tunkijanansin et al., 2020)被用于测定各种食品中的这些防腐剂。随着新食品种类的不断涌现和现有食品中含有大量防腐剂的趋势,需要一种能有效减少食品基质的优质纯化工艺。此外,还需要进行准确的分离和定量分析。在整个食品分析过程中,复杂的食品基质阻碍了分离技术的定量分析。在实际样品中,从食品基质中消除干扰物质对于分析物的准确测量是重要的。样品制备采用多种提取方法,如液-液萃取(LLE) (Tighrine等人,2019)、分散液-液微萃取(DLLME) (Sun等人,2014;Javanmardi et al., 2015;Ding等人,2018)、固相微萃取(SPME) (Tungkijanansin等人,2020)和固相萃取(SPE) (Win等人,2019)。在国际乳业联合会(IDF)中,仅使用溶剂提取可能无法充分去除干扰物质,乳化样品使用carez溶液进行分析(ISO, 2008)。为了有效地分析加工食品,在固相萃取法中,HLB法和C18法在去除蛋白质、盐和有机酸方面表现优异,carez法在去除蛋白质和脂类方面表现优异。
本研究的主要目的是开发和验证一种分析方法,适用于出于安全原因添加防腐剂(脱氢乙酸、苯甲酸、山梨酸、对羟基苯甲酸甲酯、对羟基苯甲酸乙酯)的所有食品类型。目前,韩国食品法典提出了蒸汽蒸馏法和溶剂萃取法。蒸汽蒸馏法虽然应用广泛,但耗时长,操作复杂。此外,溶剂萃取法仅限于某些食品类型,并且不经过任何纯化过程,这使得分析由于基质的干扰峰而变得困难。在本研究中,比较了三种纯化方法(SPE(C18, HLB), carez试剂溶液),以建立高效液相色谱法同时分析五种防腐剂的最佳方法。此外,还对商业加工食品进行了监测,以验证所建立的防腐剂分析方法的适用性。因此,本研究建立了最快、最简单的防腐剂同时分析方法。所开发的分析方法可以同时分析防腐剂(脱氢乙酸、苯甲酸、山梨酸、对羟基苯甲酸甲酯、对羟基苯甲酸乙酯),并可用于所有类型的食品。由于预处理过程简单,净化效果优异,将节省大量的时间和成本。
材料与方法
样品收集
共从韩国的市场、百货公司和网上零售商处购买了521种加工食品。样本分为13类根据韩国食品代码:面包(n = 20)、糖(n = 20)加工产品,堵塞(n = 20),食用油和脂肪(n = 20)、饮料(n = 67),酱油和贴(n = 72),调味食品(n = 109),腌制食品和红烧食品(n = 41),酒精饮料(n = 20),肉制品(n = 20),乳制品(n = 45),渔业加工食品(n = 55),加工农业食品(n = 12)。随机抽取含有防腐剂的产品和未标记的产品。所有样品使用搅拌器(Blixer 5 plus, Robot Coupe, Vincennes, France)均质,并保存在-20°C直到分析。
同时,通过从具有防腐剂使用标准的食品组中选择具有代表性的加工食品进行验证。果酱是含糖量高的代表,酱油是含盐量高的代表,奶酪是含蛋白质和脂肪的代表。
试剂
标准级脱氢乙酸、山梨酸、苯甲酸、对羟基苯甲酸甲酯、对羟基苯甲酸乙酯、四正丁基氢氧化铵和磷酸购自Sigma-Aldrich (St. Louis, MO, USA)。乙醇和乙腈作为提取溶剂,从默克公司(法兰克福,德国)获得。超纯水(电阻率≥18 MΩ)来自milliore - q超纯水净化系统(Millipore, Billerica, MA, USA)。采用铁氰化钾(Sigma-Aldrich, St. Louis, MO, USA)和七水合硫酸锌(Merck, Frankfurt, Germany)作为carz溶液I和carz溶液II。所用试剂均为分析级以上。
溶液的制备
将100 mg脱氢乙酸(DHA)、山梨酸(SA)、苯甲酸(BA)、对羟基苯甲酸甲酯(MP)、对羟基苯甲酸乙酯(EP)用100 ml容量瓶溶解于100 ml甲醇中,制备单独的标准原液。在不同浓度下,用甲醇稀释已知等分的原液,制备浓度为0.3、0.6、1.2、3、6、15、30和60 mg/kg的DHA、SA、BA和浓度为0.5、1、5、10、25、50和100 mg/kg的对羟基苯甲酸酯(EP、MP)的工作标准溶液。原液按月配制,工作标准液按日配制。用Carrez溶液I将亚铁氰化钾溶于水至15%的浓度,用Carrez溶液II将硫酸锌溶于水至30%的浓度。
不同净化工艺回收率的比较
固相萃取法采用C18墨盒
众所周知,C18滤筒在去除盐和有机酸方面非常出色,并且已经使用防腐剂进行了研究(Yun等人,2019)。在代表性样品(果酱、酱油、奶酪)中添加40 mg/kg进行回收率试验。按照Yun et al.(2019)报道的方法对果酱、酱油、奶酪样品中的防腐剂(DHA、SA、BA、MP、EP)进行溶剂萃取,并分别进行SPE纯化。溶剂萃取过程中,取匀浆后的样品4 g置于含40 ml乙醇的锥形管中,超声10 min, 1500 × g离心10 min。纯化过程中,5ml上清通过活化C18固相萃取柱(Waters, MA, US;色谱柱在活化前用5ml甲醇、5ml水和1ml乙腈预处理,然后用5ml甲醇预处理。总溶液用氮气干燥,分析物用1 ml乙腈洗脱,用聚偏氟乙烯(PVDF) 0.22 μm膜注射器过滤器(Teknokroma, Barcelona, Spain)过滤。
固相萃取法采用HLB滤芯
HLB墨盒是专门用于去除蛋白质、盐和脂质的墨盒,参照Wang et al.(2013)的实验方法进行了一些修改,并进行了对比实验。该方法与使用C18的方法相同,只是用HLB进行了不同药筒的实验。
用卡鲁兹试剂纯化
carez溶液对食品中防腐剂的溶剂提取和纯化是按照Abedi et al.(2014)报道的程序进行的,并做了一些修改。溶剂萃取过程中,取4 g样品置于锥形管中。加入10 ml乙醇后,加入1 ml六铁氰化钾(Carrez溶液I)和1 ml醋酸锌(Carrez溶液II)。然后,将封闭的试管轻轻摇晃1分钟,以促进混浊溶液的形成。将产物与乙醇40 ml混合,超声5 min, 1500 × g离心10 min。上清液采用PVDF 0.22 μm膜式注射器过滤器过滤。
仪器和色谱条件
定量分析采用Agilent Technologies 1260系列高效液相色谱(Agilent Technologies, CA, USA),配备二极管阵列检测器(DAD)。色谱分离采用Capcell pak MF-C8色谱柱(4.6 mm id × 150 mm, 5 μm, Phenomenex, CA, USA)。以0.01 mol/l四正丁基氢氧化铵、0.1%水溶液磷酸(v/v)、乙腈为洗脱液的梯度流动相进行分离,最佳梯度分离条件为:初始浓度为25%;2.5 min, 25% B;7分钟,35% B;12分钟,40% B;12.1 min, 90% B;柱温保持在40℃,流速为1 ml/min,进样量为10 μl。为确认5种成分,在负离子电喷雾电离(ESI(-))模式下,对标准品和样品进行多重反应监测(MRM)下的LC-MS /MS分析。AB sciex Triple Quad 4500 (sciex, Framingham, USA)质谱仪与Nano space SI-2 3004(资生堂,东京,日本)LC系统相结合。LC-MS /MS设置为:UK025T (2.0 × 150 mm, 3 μm);流动相为10 mM乙酸铵水溶液(A)和乙腈溶液(B);梯度初始值为15% B;13.5 min, 60% B;14.0 min, 80% B;16.0 min, 80% B;16.1 min, 15% B;20 min, 15% b,注射量2 μm。在前体/产物离子m/z 167/82.9、121/77、111/67、151/91.9、165/92.3处分别检测到DHA、SA、BA、MP和EP。
方法验证
从线性、检出限(LOD)、定量限(LOQ)、选择性、准确度(回收率)、精密度(相对标准偏差%RSD)和测量不确定度等方面对产品中DHA、SA、BA、MP和EP的测定方法进行了验证。根据AOAC(官方分析化学协会)的选择性、准确度、精密度、LOD、LOQ指南(AOAC, 2012b)、GUM(测量不确定度表达指南)和EURACHEM不确定度测量指南(ISO, 1993;EURACHEM, 2000)。通过3次重复的校准曲线和计算相关系数(r2)来评价线性度。根据8种浓度下的校准曲线计算LOD和LOQ值。分别确定为3.3和10 σ/S,其中σ指截距的标准差,S指从校准曲线确定的回归线的斜率。通过分析标准溶液和加入原液的3种代表性样品(果酱、奶酪、酱油)的色谱图,考察基质干扰,验证了选择性。通过分析加入原液的3种代表性样品(果酱、奶酪、酱油),得到最终浓度分别为20、40和100 mg/kg,评估准确度和精密度。进行了日内(同一天三次重复)和日内(三天三次重复)精度测试。根据GUM和EURACHEM指南(ISO, 1993;EURACHEM, 2000)。根据校准曲线、食品矩阵(可重复性)、标准品制备和样品制备四个组成部分测定不确定度。选取防腐剂浓度为40 mg/kg计算不确定度。通过6次分析确定样品的重复性。测量不确定度(U),即扩展不确定度,通过将组合标准不确定度乘以覆盖因子(k = 2)来计算,得到的置信水平约为95%。
实验室间比较:国际Nal能力测验
为了证明本研究的适用性,通过参与食品分析绩效评估计划(FAPAS, Fera Science Ltd., York, UK)进行国际比较能力评估,该计划是由英国环境,食品和农村事务部运营的一个能力计划。FAPAS对食品营养、食品添加剂、农药残留等10个领域的Z分数(实验室间误差范围)作为国际水平测试进行分析,并给出结果。结果被评估为z分数,如果x是参与者报告的结果,xa是分配的值,σP是熟练度的标准差,那么它在统计上是令人满意的。
目录
摘要 介绍 材料与方法 结果与讨论 结论 参考文献 作者信息 道德声明 搜索 导航 #####结果与讨论
HPLC条件优化
对分析物进行紫外扫描(200-400 nm),以减少干扰化合物,并评价该方法的选择性。对于检测波长,分析物的最大吸收存在差异。韩国食品法规规定,5种防腐剂的波长为λ = 217 nm。然而,波长测试的结果表明,λ = 235 nm的单一波长是检测五种防腐剂的最佳折衷方案。与217 nm相比,对羟基苯甲酸酯(对羟基苯甲酸甲酯、对羟基苯甲酸乙酯)在235 nm的敏感性略有下降,但山梨酸的敏感性显著提高(数据未显示)。分析物的紫外扫描显示,标准溶液和处理样品中防腐剂峰的紫外全扫描(200-400 nm)之间没有明显差异。在色谱条件下,5种防腐剂分离良好,峰清晰。因此,当应用实际矩阵时,该方法被证明具有很高的选择性(图1)。
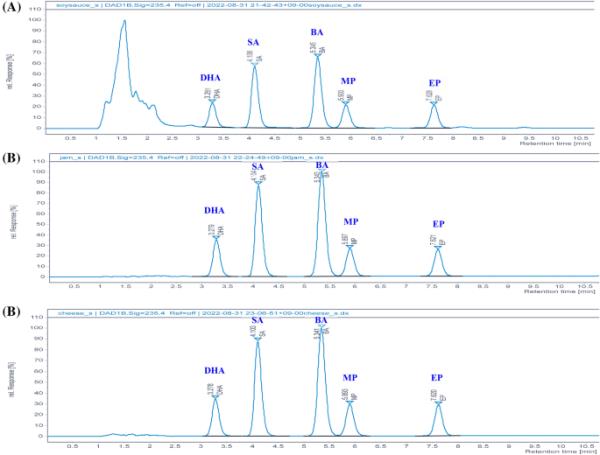
235nm波长下防腐剂的色谱分离A混合标准溶液(40mg /kg)酱油的色谱图滞留时间(RT): DHA, 3.043;SA 4.077;英航,5.554;MP, 6.046;EP, 7.612。混合标准溶液(40mg /kg)加标奶酪B色谱图;滞留时间(RT): DHA, 3.043;SA 4.077;英航,5.554;MP, 6.046;EP, 7.612。C混合标准溶液(40mg /kg)加标果酱色谱图;滞留时间(RT): DHA, 3.043;SA 4.077;英航,5.554;MP, 6.046;EP, 7.612
建立的方法
首先,对提取溶剂的测定,采用乙腈、丙酮、乙醇、甲醇四种提取溶剂进行了回收率试验,并对结果进行了比较。溶剂测试结果表明,两种方法的溶剂回收率无显著差异。虽然差异不大,但乙醇具有优势,并选择乙醇作为提取溶剂。
通过对三种具有代表性的食品(果酱、奶酪、酱油)的纯化工艺进行比较,carz试剂法在回收率和选择性上普遍表现出更好的结果(表1)。固相萃取法虽然在去除加工食品基质方面表现良好,但在通过滤筒和氮浓缩步骤的过程中,回收率似乎有所损失。人们还认为,在这些实验步骤中发生了很大的变化。此外,由于使用泵和氮气浓度加载时间较长,SPE装药盒(C18, HLB)方法需要较长的时间。同时,卡鲁兹试剂法具有回收率高、准确度好、变异性好、耗时短等优点。因此,确定采用卡鲁兹试剂法为合适的纯化工艺。在乙醇提取法的情况下,由于离心后的上清是简单提取后进行分析,脂肪和蛋白质没有被充分去除,特别是乳化食品如奶酪、黄油的乳化特性不能被破坏,所以回收率较低。
Carrez溶液广泛用于蛋白质和脂肪的纯化,它可以分解干扰碳水化合物等小分子结晶的乳剂(Chávez-Serví et al., 2004;Manzi and Pizzoferrato, 2013;Marconi et al., 2004;Pereda et al., 2009)。因此,carcarz澄清工艺是蛋白质沉淀和浊度去除的最佳工艺(Oliveira-Neves等,2018)。因此,使用carez试剂的纯化过程被认为对各种类型的食品分析都很好。
方法验证
分析方法具有良好的线性、定量限、定量限、准确度和精密度。校正曲线与分析物呈线性关系。相关系数(r2)均大于0.9998。防腐剂的lod和loq见表2。分别以20、40和100 mg/kg的果酱、奶酪和酱油为加标空白样品,对方法的准确度(回收率)和精密度进行了评价。验证结果总结如表2所示。各样品防腐剂回收率在87.7 ~ 110%范围内。日内和日间的精密度用rsd表示,精密度范围为0.07 ~ 7.72%。这些回收率和精密度均在AOAC指南(AOAC, 2012b)规定的标准范围内。
加工食品中分析物浓度的测量不确定度,用mg/kg表示,由扩展标准不确定度计算,覆盖系数为k = 2,置信度约为95%。总相对不确定度由校准曲线、样品基质(重复性)、标准品制备和样品制备4个因素的综合相对不确定度表示。将相对不确定度与被分析果酱的浓度(40 mg/kg)结合计算标准不确定度。在组合标准不确定度的基础上计算扩展不确定度。果酱中DA、SA、BA、MP、EP的最终分析浓度分别为44.7±2.2、44.0±2.1、44.4±2.0、44.3±2.1和43.4±2.2 mg/kg。测量不确定度的每个因素的结果总结在表3中。
能得到Nal水平测试结果
第一次国际比较熟练度评价的分析样品选择软饮料(软饮料,03160),山梨酸的z-score为0.5,苯甲酸的z-score为- 0.6。第二个分析样品是果酱(jam, 20171),其评估值为−0.2山梨酸和0.0苯甲酸。z-score(实验室间误差范围)≤2被认为在统计学上是满意的。这些结果证实了本研究中使用的实验方法的准确性。
莫国产加工食品中防腐剂监测结果
表4为用carez试剂验证所建立方法适用性的监测结果。图2显示了监视结果的每个组件的分布。在收集的产品中,10个黄油产品中有2个和10个人造黄油产品中有6个被发现与DA结合。6例标签均检出DA,范围为32 ~ 144mg /kg,符合500 mg/kg(韩国标准)的规定。
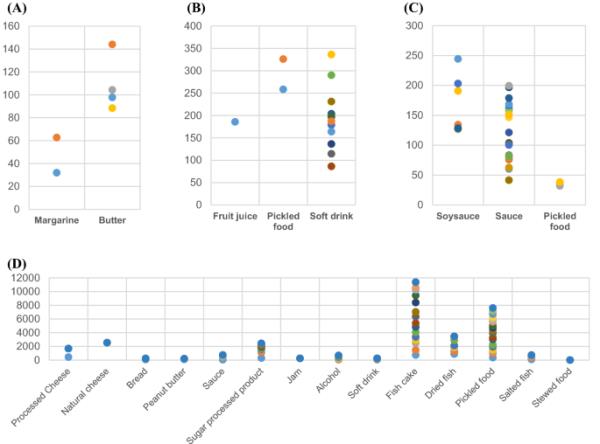
防腐剂检测分布。A脱氢乙酸检测分布。B检测苯甲酸的分布。C对羟基苯甲酸乙酯的检测分布范围较广,为41.5 ~ 244mg /kg。D对于山梨酸的检测分布,加工鱼类产品的检测范围为312 ~ 1363 mg/kg,腌制食品的检测范围为86.6 ~ 791 mg/kg
由于SA是使用最广泛的防腐剂,它的用途多种多样,奶酪、鱼饼、鱼干、泡菜、酱料、糖浆、果酱、面包和酒精饮料等多种食品中都含有SA。共收集标注SA的114个项目:加工奶酪10例,天然奶酪1例,鱼干酱8例,果酱1例,糖制品11例,花生酱2例,面包3例,酱料10例,鱼肉制品15例,腌制食品19例,蒸煮食品1例,咸鱼4例,酒精饮料16例,碳酸饮料4例。其中,8种腌制食品、1种鱼干、5种酱料、1种面包和9种酒精饮料因成分低于定量限而未检出。蒸煮食品中SA的检出量最低,为7 mg/kg,天然奶酪中SA的检出量最高,为2532 mg/kg。除面包被列入无使用标准产品组外,其余均符合使用标准。但由于原料中含有人造黄油,因此被判定为适宜(使用标准不超过2000 mg/kg)。
作为BA标签的产品,收集了1种果蔬汁、3种炖食品、4种腌制食品和12种碳酸饮料。研究发现,BA在饮料中的应用尤为广泛。在被标注的产品中,有3种炖煮食品和1种腌制食品被归类为未检测,因为它们低于LOQ。果蔬汁和软饮料中BA的使用标准为600 mg/kg,腌制食品中BA的使用标准为1000 mg/kg。
在市场上的加工食品中,没有在所有食品中收集和检测到含有MP的产品。
作为标注EP的产品,共收集了40个项目:酱油7个,酱料26个,腌制食品5个,炖食品2个。结果表明,它们在酱料中的应用较为广泛。EP的使用标准是酱油250毫克/公斤,酱汁、腌制食品和炖食品200毫克/公斤。除检测值低于限定限的7例(酱料3例、炖煮食品2例、腌制食品2例)外,其余均符合规定。
在本次研究中,天然奶酪中山梨酸的含量为2532 mg/kg,在标准范围内,但含量很高,其次是鱼类产品中山梨酸的含量为1363.3 mg/kg,加工奶酪中山梨酸的含量为1238 mg/kg,糖浆中山梨酸的含量为801.1 mg/kg,泡菜中的山梨酸含量为791.3 mg/kg。根据Lee等人(2013)之前的研究,加工奶酪的检测最高,为761.7 mg/kg,加工鱼肉产品为712 mg/kg,干燥储存肉为585.3 mg/kg,咸味海鲜为492.4 mg/kg,香肠为369.5 mg/kg。然而,在咸鱼和香肠等其他物品上存在一些差异。在本研究中,除两例泡菜外,大多数饮料中苯甲酸的检测值为206.5 mg/kg。Lee et al.(2013)报道,在饮料中检测到苯甲酸为86.5 mg/kg,在泡菜中检测到13.6 mg/kg,差异很大,但与本研究一样,在果酱中未检测到苯甲酸。
Shin等人(2017)通过估计每日摄入量(EDI)来评估摄入风险,苯甲酸EDI的主要原因是饮料,山梨酸EDI的主要原因是大豆酱、加工鱼制品和泡菜。此外,Yoon et al.(2001)也报道了苯甲酸的暴露主要是由于饮料,因此有必要对饮料进行定期监测。
在此次调查中,对国内市场上销售的加工食品进行了随机抽样调查,结果显示,大豆酱中没有检测到山梨酸,但在25件加工水产品中,有7件检测到山梨酸,在26件加工泡菜中,有19件检测到山梨酸,分别检测到ND-876毫克/公斤和ND-791毫克/公斤。经证实,山梨酸在腌菜中是常用的。检测量均在标准范围内,处于安全水平。22例饮料中检出苯甲酸12例,检出量为ND-336 mg/kg,也远低于标准,确认为安全水平。通过这种快速准确的方法进行监测,可以通过不断的研究,作为食品添加剂安全使用的研究数据。
下载原文档:https://link.springer.com/content/pdf/10.1007/s10068-023-01264-7.pdf

