摘要
本研究建立了固相微萃取(SPME) -三重四极杆气相色谱-串联质谱法定量小鼠粪便样品中8种短链脂肪酸(SCFAs)的方法。此外,研究了影响SCFA分析的重要因素,包括SPME纤维选择、pH、盐析剂和样品采集时间。与之前的研究相反,我们发现CAR/PDMS纤维对所有scfa的提取效率最高。在pH为2.0时,提取效率最高,特别是对低分子量scfa。NaH2PO4具有较好的pH稳定性,且对溶剂基质的干扰较小,萃取效果优于NaCl。此外,我们的结果表明,SCFA浓度随着收集时间的增加而增加。8种scfa的组成比例维持24 h;因此,我们得出结论,样品应在4小时内收集,以获得可靠的结果。我们的发现可能会改进SCFA提取和小鼠粪便样本分析的实验室方法。
图形抽象
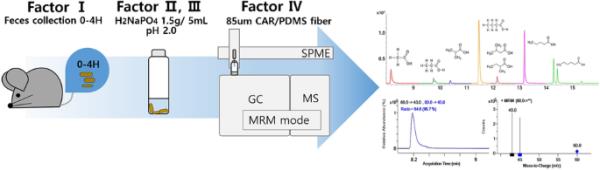
介绍
短链脂肪酸(Short-chain fatty acids, SCFAs)是一种碳原子数小于6的羧酸类有机酸,主要由膳食纤维和不可消化多糖的肠道微生物发酵产生[1]。最重要和最丰富的SCFAs是乙酸(C2)、丙酸(C3)和丁酸(C4)。除了这些化合物,其他C4-C6短链脂肪酸,如戊酸和己酸,已经在肠道微生物群中被广泛研究其潜在的健康益处。
关于短链脂肪酸在人体健康和机体功能中的生理作用已经进行了大量的研究。在过去的十年中,人们对血浆[2,3]、血清[3,4]、小鼠粪便[5]、人类粪便[6,7,8]、尿液[6]和发酵培养基[9]等多种生物材料中SCFAs的分析越来越感兴趣。特别是,根据最近的文献,对不同的样品制备和分析方法以及人类粪便中SCFA分析结果的可靠性进行了系统的回顾和总结。然而,许多研究使用小鼠模型,并试图估计小鼠粪便中的SCFA水平。微生物产生的SCFAs只有5%存在于粪便中,这不足以解释肠道状况和肠道菌群[10]。尽管如此,使用粪便样本被认为是无创的和普遍的,并且关于健康益处与粪便中scfa含量之间的相关性的一些可靠结果已被广泛报道。与人类粪便相比,利用小鼠粪便进行SCFA分析需要考虑的最重要因素是只能获得极少量的样品,这导致了对提高SCFA分析方法分析效率的研究。在分析小鼠粪便中的短链脂肪酸时,需要考虑一些关键的制备和分析步骤以提高分析效率,如粪便样本收集、短链脂肪酸提取和仪器条件。
此外,根据最近的科学文献,气相色谱法(GC)因其识别和测量单个SCFAs的敏感性和特异性而成为定量SCFAs的主要分析技术。此外,在各种研究中也报道了替代方法,包括液相色谱(LC),由于其出色的分辨率,在分析复杂基质时特别有用,以及核磁共振(NMR),它为scfa的定量提供了一种非破坏性和高度可重复性的方法,尽管与色谱技术相比,它的灵敏度较低。然而,尽管有这些替代方法,气相色谱是最广泛使用的SCFA定量方法,反映了其稳健性、准确性和可靠性[11]。过去,大多数研究人员使用预处理方法,如衍生化、萃取或蒸馏,但最近在SCFA定量研究中,固相微萃取(SPME)与GC-MS相结合的使用明显增加。然而,大多数分析SCFAs的研究主要使用人类粪便或血液样本,而不是小鼠粪便样本。因此,需要进行更多的研究,以克服与使用有限样本量进行这些分析相关的挑战。
在本研究中,我们旨在建立一种顶空固相微萃取(SPME)和气相色谱-质谱联用(GC-MS /MS)分析小鼠粪便样品中SCFAs的方法。在众多分析因素中,我们重点研究了SPME法提取条件,包括粪便基质对盐和pH的影响,并考察了小鼠粪便新鲜度的影响,以确定样品采集条件。通过不同的SPME纤维提取率、pH值和盐析效果、三重四极柱GC-MS /MS条件以及基于粪便样品新鲜度的结果可靠性,建立了8种SCFAs的测定方法。因此,在本研究中,鉴于小鼠粪便样品中SCFA分析的重要性,旨在开发一种敏感可靠的方法来提高顶空SPME提取SCFA的效率,并建议如何收集小鼠粪便样品。我们的结果将有助于其他研究人员不仅在小鼠粪便样本中分析SCFAs,而且在其他人类和动物生物材料中分析SCFAs。
材料与方法
化学品和试剂
乙酸(99.7%)、乙酸-1- 13c(99%)、丙酸(99.5%)、丙酸-d2(99%)、异丁酸(99%)、丁酸(99.5%)、丁酸-1- 13c(99%)、2-甲基丁酸(97%)、异戊酸(98.5%)、戊酸(99.8%)、戊酸- 13c(99%)、己酸(99%)、己酸-d11(99%)、磷酸一钠(NaH2PO4, 99%)、氯化钠(NaCl, 99.5%)、硫酸(99.9%)购自Sigma-Aldrich (St. Louis, MO, USA)。水(液相色谱-质谱级)购自Merck (Darmstadt, Germany)。
原液和样品制备
将乙酸(1.00 g)、丙酸(0.10 g)、异丁酸(0.05 g)、丁酸(0.05 g)、2-甲基丁酸(0.01 g)、异戊酸(0.01 g)、戊酸(0.05 g)和己酸(0.01 g)溶解于100ml水中,制备标准混合SCFA原液。制备了乙酸-1- 13c (C2) (12.21 mg/L)、丙酸-d2(C3) (2.28 mg/L)、丁酸-1- 13c (C4) (1.35 mg/L)、戊酸-1- 13c (C5) (0.10 mg/L)、己酸-d11(C6) (0.13 mg/L)的内标(IS)混合溶液。所有原液保存在4°C的安全条件下,使用前用盐缓冲液稀释。
用1.5 g/ 5ml浓度的NaCl和NaH2PO4进行盐渍,用硫酸将pH调节为2.0、2.5、3.0和3.5,并用pH计(Seven Compact S220, Mettler Toledo, Greifensee, Switzerland)进行测定。对于粪便基质效应,均质粪便样品(300 mg)在含有盐缓冲溶液(5 mL)的20 mL SPME玻璃瓶(Gerstel, m
收集动物和粪便样本
7周龄雄性C57BL/6 J小鼠来自Orient Bio (Gyeonggi-do, South Korea),饲养在SPF动物设施中,在21±2°C的受控环境条件下,在光暗室中自由饮水。小鼠喂食Teklad Global 18%蛋白质啮齿动物饲料(2918C;Harlan Teklad, Madison, WI, USA)。所有动物实验均经过韩国食品研究院动物福利委员会(KFRI-M-22038)的审查和批准。在3周的驯化后,立即在代谢笼中收集粪便样本,在换笼4和12小时后,立即在- 80°C保存,以待下次使用。
顶空SPME萃取和GC-MS /MS分析
测试了三种类型的纤维来评估SCFAs的吸附:涂覆85 μm CAR/PDMS的23 Ga纤维,50/30 μm DVB/CAR/PDMS和100 μm PDMS (Supelco, Bellefonte, PA, USA)。在使用之前,所有纤维在多用途取样器(MPS;Gerstel, Sursee, Switzerland)根据制造商的建议。接下来,使用MPS和自动SPME取样提取化合物。将小瓶加热并在60°C下孵育10分钟,在300 rpm下搅拌10和1 s。85-μm CAR/PDMS纤维在280°C预烘烤3分钟后,在60°C下暴露于样品中15分钟。提取的挥发物在250°C下使用GC进样器解吸1分钟。为了防止分析物携带,每次提取后,SPME纤维后烘烤12分钟。
采用7890A气相色谱联用7000C TQ质谱联用(Agilent, Santa Clara, CA, USA),在DB WAXetr毛细管柱中分离SCFA,色谱柱直径为30 m × 250µm,膜厚为0.25µm (Agilent)。初始温度为80℃,保温2min,以10℃/min升温至100℃,以5℃/min升温至130℃,以10℃/min升温至160℃,以20℃/min升温至220℃,保温2min。最终温度为240℃,保温4min,清洗色谱柱。以氦气为载气,以1 mL/min的恒流量进行注射。总运行时间为16分钟,溶剂延迟8分钟。
MS传输线温度设置为240℃,EI源和四极体保持在230℃和150℃。以N2为碰撞气体,流量为1.5 mL/min, He为淬火气体,流量为2.25 mL,操作三重四极杆。每种化合物的多反应监测(MRM)指标列于补充表1。
数据分析
使用MassHunter工作站软件版本B.07.00 (Agilent)进行SCFAs的相对和绝对定量。分别在信噪比为3.3和10的条件下,对稀释后的标准溶液进行选峰、计算峰面积、构建标准曲线、检出限和定量限。通过内标校准曲线评价各单品的线性度,并进行线性回归分析,确定各校准曲线的斜率、相关系数和截距。LOD和LOQ采用回归线y截距的标准差(r)和斜率(s)计算。所用公式LOD = 3.3r/S, LOQ = 10r/S。采用内标调整峰面积构建标准曲线,对粪便中SCFA浓度进行量化,每个SCFA的碳数相等。
数据以均数±标准差(sd)表示。根据8种scfa的相对峰面积确定提取效率。用变异系数(CV)、sd与均值之比评价方法的精密度和重现性,并以百分数表示。采用Prism软件版本9 (GraphPad, San Diego, CA, USA)进行单因素分析,如t检验、单因素方差分析(ANOVA)和Tukey多重比较极差检验。
目录
摘要 介绍 材料与方法 结果 讨论 结论 参考文献 作者信息 道德声明 补充信息 搜索 导航 #####结果
SPME纤维的性能
通过比较三种SPME纤维的相对面积,评价了三种SPME纤维的萃取效率和重现性。图1显示,CAR/PDMS纤维(8.5 × 105 ~ 3.8 × 107)对scfa的提取效率最高,其次是DVB/CAR/PDMS纤维(2.1 × 105 ~ 2.0 × 107)和PDMS纤维(1.1 × 104 ~ 4.6 × 105) (p < 0.05)。与CAR/PDMS纤维相比,DVB/CAR/PDMS纤维和PDMS纤维的提取效率分别为24.8 ~ 57.9%和0.7 ~ 7.9%。与此同时,CAR/PDMS纤维的变异系数(CV%)值(1.2 ~ 21.8%)低于DVB/CAR/PDMS纤维(0.5 ~ 23.3%)和PDMS纤维(0.3 ~ 58.4%),表明CAR/PDMS纤维具有较高的重复性。由于萃取效率高、重现性好,我们选择CAR/PDMS纤维进行SCFA萃取,并在后续实验中用于测定含水盐溶液的盐析效果。
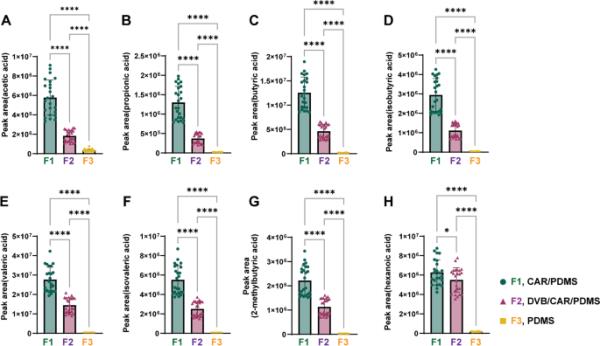
固相微萃取(SPME)纤维对8种短链脂肪酸(SCFAs)萃取效率的影响每个面板表示A:乙酸,B:丙酸,C:丁酸,D:异丁酸,E:戊酸,F:异戊酸,G: 2-甲基丁酸和H:己酸的峰面积。三种不同类型的光纤分别表示为F1 (CAR/PDMS,绿色圆圈)、F2 (DVB/CAR/PDMS,紫色三角形)和F3 (PDMS,黄色方框)。星号表示差异显著(*p < 0.05, ****p < 0.0001)
SCFA分析pH值的优化
为了研究pH对SCFA提取的影响,我们使用不同pH值的NaH2PO4水溶液分析了小鼠粪便中SCFA的含量。图2显示了pH值对8种小鼠粪便SCFAs提取效率的影响。除己酸在pH 3.0时较高外,粪便重量校准的scfa相对面积随着pH的增加而减小。乙酸、丙酸、丁酸、戊酸和2-甲基丁酸在pH 2.0 ~ 3.5之间显著降低(p < 0.05)。在此基础上,我们将NaH2PO4水溶液的pH值优化为2.0,该pH值对粪便样品的盐析效果最为明显。
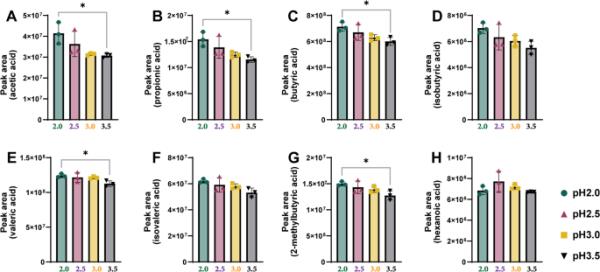
pH对8种scfa提取效率的影响。每个面板表示A:乙酸,B:丙酸,C:丁酸,D:异丁酸,E:戊酸,F:异戊酸,G: 2-甲基丁酸和H:己酸的峰面积。星号表示差异显著(*p < 0.05)。
粪便SCFA分析中的盐析效应
我们检测了使用SPME分析系统中最常用的盐析剂NaCl和NaH2PO4提取SCFA的量,以研究它们对小鼠粪便中SCFA提取的影响。根据化合物的相对面积评价盐析剂的萃取效果。如图3A-H所示,NaCl可能是从水基质中提取所有8种scfa的有效盐析剂。同时,在小鼠粪便基质中,NaH2PO4是一种更有效的盐剂,两种盐剂在小鼠粪便基质中的差异更大。在粪便基质中,NaCl的CV%值为43.2 ~ 136.6%,而NaH2PO4的CV%值仅为4.9 ~ 16.2%(图3a-h),说明与使用NaCl相比,NaH2PO4显著降低了CV%值。这一有趣的观察结果表明,NaH2PO4提高了SCFA分析数据的再现性和可靠性。为了检验这一显著的结果,我们在加入小鼠粪便样本后,分析了每种盐水溶液的pH值,结果见表1。NaCl水溶液的pH值从酸性条件(pH 2.0-3.5)迅速上升到中性条件(pH 6.5-6.8),而NaH2PO4水溶液在加入小鼠粪便后非常稳定。基于这些观察结果,我们选择NaH2PO4作为SCFA分析的盐析剂。
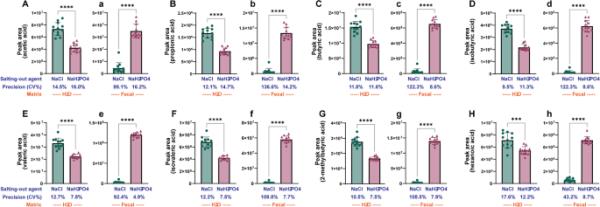
NaCl、NaH2PO4的盐析作用和粪便基质对8种scfa提取效率的影响。每个面板表示A:乙酸,B:丙酸,C:丁酸,D:异丁酸,E:戊酸,F:异戊酸,G: 2-甲基丁酸和H:己酸的峰面积。大写字母和小写字母分别代表水和粪便基质效应。星号表示差异显著(***p < 0.001, ****p < 0.0001)
样品采集时间对SCFA分析的影响
我们研究了以收集时间为基础的小鼠粪便样品新鲜度对SCFAs组成和浓度的影响。我们使用先前确认的参数(包括CAR/PDMS SPME纤维和pH为2.0的NaH2PO4水溶液)对三个不同时间点收集的小鼠粪便样本中存在的8种SCFAs进行了量化(图4)。结果表明,SCFAs的浓度随着样本收集时间的延长而增加,除了2-甲基丁酸,在4小时的样本收集中发现其浓度显著升高(p < 0.05)(图4A-H)。在SCFAs的总比例中,乙酸、丙酸和丁酸含量最多。有趣的是,随着粪便收集时间的推迟,占总SCFA含量四分之三的乙酸和丙酸浓度增加。这是由于CV%的增加,这随后降低了SCFA分析结果的可靠性。SCFA组成为:乙酸(60.7 ~ 67.2%)>丁酸(16.5 ~ 21.0%)>丙酸(9.7 ~ 10.4%)>异戊酸(2.9 ~ 3.9%)>戊酸(1.7 ~ 2.0%)> 2-甲基丁酸(0.9 ~ 1.6%)>异丁酸(0.8 ~ 1.0%)>己酸(0.04 ~ 0.07%)。虽然已酸的比例从0 h时的0.04%显著增加到4 h时的0.07%,但这种变化对SCFA组成没有影响(p < 0.05)。基于这些结果,我们建议在4小时内收集小鼠粪便样本,以获得可靠的分析结果。
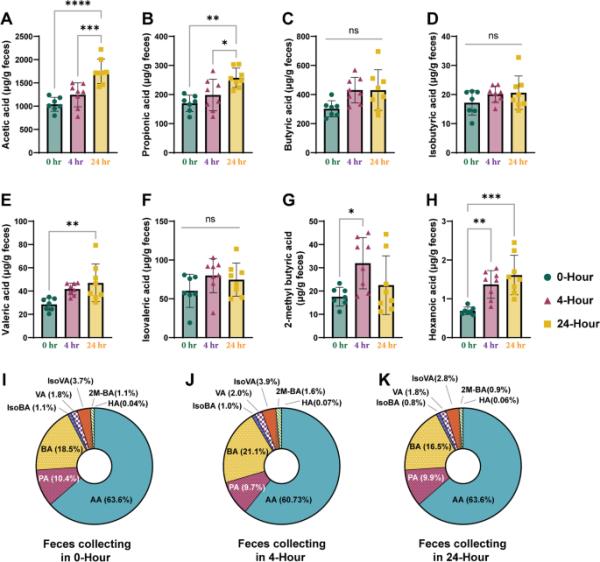
小鼠粪便样品新鲜度对8种SCFAs分析的影响。每个面板表示A:乙酸、B:丙酸、C:丁酸、D:异丁酸、E:戊酸、F:异戊酸、G: 2-甲基丁酸和H:己酸的浓度。峰面积除以每个SCFA具有相同碳数的内标准峰面积。星号表示显著差异(* * * p < 0.05, p < 0.01, * * * p < 0.001, * * * * p < 0.0001)
SPME-GC-MS /MS法测定SCFAs的定量限和定量限
8种短链脂肪酸的LOD和LOQ见表2。乙酸的LOQ和LOD均显著高于其他7种scfa。绘制了6 ~ 8个点的标定曲线,结果表明:乙酸3.063 ~ 404.840 μg、丙酸0.286 ~ 38.200 μg、丁酸0.149 ~ 19.920 μg、异丁酸0.145 ~ 19.400 μg、戊酸0.155 ~ 20.760 μg、异戊酸0.028 ~ 3.840 μg、2-甲基丁酸0.037 ~ 4.920 μg、己酸0.029 ~ 3.920 μg均具有良好的线性关系。除乙酸(R2 = 0.9975)外,其余scfa的相关系数均大于0.999 (r²)。LOD和LOQ值是指用于分析小鼠粪便样品中SCFAs的范围,使用约2-3块或50-70 mg的粪便进行分析。
讨论
在此,我们提出了一种高效且可重复的方法,用于定量8个含有最多4个碳原子的scfa。各种提取和分析因素影响分析;因此,我们研究了三种SPME纤维的性能,SCFA提取时的pH条件,盐析剂以及小鼠粪便样品新鲜度的影响。
SPME纤维类型的选择是顶空SPME - gc - ms分析的主要考虑因素之一,而碳和PDMS是SPME纤维中最常用的涂层材料。Carboxens通常用于分析低分子量化合物,如醇类和挥发性有机化合物,而PDMS则适用于分析非极性到中极性的化合物,包括脂肪酸、醇类和其他挥发性有机化合物[12]。在本研究中,我们发现与DVB/CAR/PDMS和PDMS纤维相比,CAR/PDMS涂层纤维对8种短链脂肪酸的提取效率最高。这一结果与之前的一项研究不一致,该研究使用了DVB/CAR/PDMS纤维类型,但没有进行对比测试[13]。据供应商介绍,DVB/CAR/PDMS适用于低分子量(C3-C20)挥发物和半挥发物,似乎非常适合于SCFA的提取。我们的结果表明,对极性化合物提供额外选择性的DVB层在分析中不是很有效。虽然有几项研究使用了DVB/CAR/PDMS纤维[5,14],但我们强烈建议,更特异的CAR/PDMS纤维更有效地靶向含有2-4个碳原子的scfa。
样品相的pH值影响分析物的电离,从而影响样品相与SPME纤维涂层之间的酸碱平衡,从而影响萃取效率。虽然有些物质对pH值的变化很敏感,从而导致其转化为其他物质,但调节和保持适当的pH值可以提高提取效率和准确性。本研究发现,溶剂pH越低,萃取效率越高,说明在低pH为2.0时,样品相中scfa与SPME纤维之间的分配平衡比增大。这一结果对于低分子量的scfa,如乙酸、丙酸和丁酸尤其明显。在pH为2.5时,己酸的萃取效率最高,说明每种分析物质需要考虑最佳溶剂pH。
SPME萃取中的盐析效应是指由于存在高浓度的电解质盐,导致溶质在水溶液中的溶解度降低[15]。这种盐析效应是决定SPME分析提取效率和灵敏度的另一个关键因素,因为它决定了基于基质中盐浓度的样品与SPME纤维之间的分配系数[16]。因此,选择合适的盐析剂应慎重考虑,以提高提取物质的数量和分析灵敏度。在这项研究中,我们比较了两种最常用的盐析剂:NaCl和NaH2PO4的SCFA萃取效率。NaH2PO4对所有8种SCFA的萃取效率都显著高于NaCl,表明它是一种比NaCl更有效的SCFA分析试剂。这与之前的研究结果一致,即(NH4)2SO4/NaH2PO4混合物的萃取效率是NaCl的4倍[15]。然而,我们也观察到,当NaCl作为盐化剂时,样品基质的pH值从2.0明显变化到6.5,而在NaH2PO4中pH值保持稳定在2.0。如前所述,低pH是提高SCFAs萃取效率的关键因素,这意味着NaCl干扰了维持低pH的溶剂基质。此外,我们观察到使用NaH2PO4时CV%值显著降低,从而提高了数据的可重复性和可靠性。
表2显示,8种scfa的LOD范围为0.115 ~ 40.03 μg/g粪便,LOQ范围为0.348 ~ 121.30 μg/g粪便。Fu等[17]采用SPME和化学衍生相结合的方法从小鼠粪便中提取了11种短链脂肪酸,并进行了GC-MS /MS分析,LOD和LOQ分别为0.01 ~ 0.72 ng/mL和0.04 ~ 2.41 ng/mL。Scortichini等[18]用GC-FID对大鼠和人粪便中的SCFAs进行了研究,LOD范围为0.04 ~ 0.64 μM, LOQ范围为0.14 ~ 2.12 μM。LOD和LOQ的差异可能源于每个研究的设备、色谱柱和样品制备方法。虽然本研究的LOD和LOQ高于其他研究,但它们足以量化小鼠粪便样本中的SCFAs。
随着人们对微生物组的兴趣日益浓厚,人们对人类粪便样本中的微生物多样性进行了研究,并建立了相应的方案[19,20]。然而,尚未有研究调查使用不同方法和时间收集的小鼠粪便样本中微生物或成分的变化。在许多临床研究中,粪便标本的获取、保存和运输的标准化方法已经被描述[21,22],例如发现样本运输时间超过两天不会影响人类粪便样本中的微生物群落。然而,对于小鼠粪便样本,收集时间和方法对分析结果的影响尚未见报道。尽管之前的研究没有明确提到收集小鼠粪便样本的速度有多快,但大多数研究人员都试图尽可能快地收集样本并立即冷冻[23,24]。把一只老鼠关在代谢笼子里,时间从1小时到3小时不等,收集粪便不仅会给研究人员带来相当大的压力,也会给老鼠带来相当大的压力。这表明用于SCFA分析的粪便收集过程也可能干扰研究的目的。因此,我们试图通过分析更换动物笼垫层时粪便SCFA含量随时间的变化来减轻实验动物的应激。定量分析表明,除2-甲基丁酸外,SCFA浓度随样品采集时间的增加而增加。这被认为是小鼠饲养环境中粪便样本蒸发和水分浓度的结果。此外,如图4I-K所示,8种scfa的组成比例随采集时间的变化不明显。这一结果可能是由于所有8种粪便中短链脂肪酸在小鼠繁殖环境中不易挥发。我们的结论是,在4小时内收集样本对于获得可靠的小鼠粪便SCFA分析结果是合理的。研究人员不必在小鼠排泄后立即收集粪便样本,从而减少了小鼠饲养环境中的压力和研究人员的工作量。在本研究中,我们实施了多种策略来提高提取效率,以克服在对小鼠粪便样本进行SCFAs定量分析时样本量极少的限制。本研究开发的实验方法将为定量分析有限数量的小鼠粪便样本中的SCFAs提供一种系统的方法。此外,我们认为需要进一步的研究来检验粪便样品中挥发性低分子化合物在本研究中分析的八种scfa类型中的提取效率。
结论
本研究旨在优化三重四极杆GC-MS /MS定量8种SCFAs的方法,并给出了可能影响分析结果的变量。结果表明,CAR/PDMS涂层的SPME纤维对scfa的提取效率最高,而过去的研究倾向于DVB/CAR/PDMS纤维,但没有进行对比测试。样品相的pH值对萃取效率有显著影响,pH值为2.0时萃取效果较好。这对于低分子量scfa尤其明显,这表明应该为每种物质考虑最佳溶剂pH。与NaCl相比,NaH2PO4在提取SCFA时更有效,因为其加入粪便后pH稳定,而NaCl会干扰维持溶剂基质的低pH。研究还分析了收集时间对SCFA组成和浓度的影响,结果表明,SCFA浓度随着时间的推移而增加,因为水分蒸发。8种scfa的组成比例随时间变化不显著;因此,我们得出结论,样品应在4小时内收集,以获得可靠的结果。
补充信息
以下是电子补充材料的链接。


