摘要
哺乳动物视网膜的形态发生取决于发育过程中基因表达的精确控制。包括微小rna在内的非编码小rna通过基因表达调控在各种生理和病理过程中发挥着深刻的作用。利用IonTorrent PGM新一代测序技术,对发育中的Wistar大鼠视网膜(出生后5天(P5)、P7、P10、P15和P21)中的小分子非编码rna的表达谱进行了系统分析,以揭示出生后早期视网膜发生的关键参与者。我们的分析揭示了微rna在视网膜发育过程中的广泛调控潜力。我们发现了一组具有恒定高丰度的microrna (miR-19, miR-101;miR-181、miR-183、miR-124和let-7)在发育过程中的表达。其他的仅存在于早期阶段(miR-20a, miR-206, miR-133, miR-466, miR-1247, miR-3582)或后期阶段(miR-29, miR-96, miR-125, miR-344或miR-664)。进一步检测到在时间上表达差异的mirna。最后,途径富集分析揭示了850个预测的靶基因,这些基因主要参与在所检测的时间段内的脂质、氨基酸和聚糖代谢(P5-P21)。P5-P7的转变揭示了mirna在谷氨酸突触和间隙连接途径中的重要性。检测到显著下调的miRNAs rno-miR-30c1和2、rno-miR-205和rno-miR-503靶向Prkx (ENSRNOG00000003696)、Adcy6 (ENSRNOG00000011587)、Gnai3 (ENSRNOG00000019465)和Gja1 (ENSRNOG00000000805)基因。这里描述的数据集将是澄清视网膜发育新调控机制的宝贵资源,并将极大地有助于我们理解microrna的分化和功能。
介绍
脊椎动物视网膜是一个多层组织,是在发育过程中一系列连续细胞事件的结果:神经祖细胞增殖、细胞命运指定、神经元迁移、神经突生长和寻路,然后最终形成突触连接(Amini et al. 2018)。多能性视网膜祖细胞(RPCs)在胚胎期(E) 9-出生后(P) 2)产生7种主要细胞类型:视网膜神经节细胞(RGCs),然后是水平细胞(E10-E15)和锥体细胞(E10-E20),最后是胚胎状态的大多数无突细胞(E10-P1)。剩余的无分泌细胞和大部分杆状光感受器(E16-P12)以及双极细胞(E20-P12)和
为了达到成熟视网膜的细胞数量特征,每种神经元细胞类型都有一个特征明确、独特的增殖高峰。虽然出生后生成的细胞具有正常或“钟形”的细胞生成曲线动力学,但早期生成的细胞可以被认为是“平台”形状(Rapaport et al. 2004)。在出生后的发育过程中,无毛细胞在第1天达到增殖高峰,杆状光感受器从出生到第6天,而米勒细胞和双极细胞在第6天达到增殖高峰,然后在第12 -第13天快速稳定地下降,直到睁开眼睛(Bagnoli et al. 2003;Bassett and Wallace 2012;Reese and Colello 1992;Rapaport et al. 2004)。大鼠视网膜中每种细胞类型的形态特征的发育从P10天持续到P21天(Johansson et al. 2000)。
视网膜神经元向相应层的迁移和分化是层流结构形成的关键。随后形成突触连接和功能性神经元回路。外神经母细胞层的细胞仅排列在P6-P8周围由外丛状层(OPL)隔开的内外核层(Bagnoli et al. 2003;阿米尼等人,2018)。在外视网膜中,光感受器与水平细胞和双极细胞接触,而视网膜神经节细胞与它们的突触前伙伴、内视网膜的无突细胞和双极细胞形成内丛状层(IPL)。虽然IPL的突触发生始于P3,而OPL的突触发生于P5,但成熟细胞的特征只有在存活细胞进入相应层时才会发生。从P7迁移后,第一个突触囊泡也出现了。受体、转运体和突触蛋白的表达在突触传递中至关重要(Bagnoli et al. 2003)。
近年来,非编码rna尤其是microrna作为复杂基因调控网络成员参与视网膜细胞多样性产生的关键因素被深入研究(Xu et al. 2007;Sundermeier and Palczewski 2012;湘2013)。目前,人们普遍认为,视网膜疾病至少部分与mirna表达异常有关,如糖尿病视网膜病变、视网膜色素变性、视网膜母细胞瘤和年龄相关性黄斑变性(Maiorano and Hindges 2012;Andreeva and Cooper 2014)。同样重要的是要知道,对Dicer消融动物的研究表明,mirna的选择性丢失导致了发育变化。在条件敲除的Dicer视网膜中,早期出生的细胞类型(如RPC)增加和延长,而如果晚期RPC标记物(包括Sox9和Ascl1)不表达,则不会产生晚期出生的细胞类型(包括杆细胞和m
大约1%的人类基因组由miRNA基因组成(Andreeva and Cooper 2014)。由于miRNA分子丰度低、体积小、序列相似性高,目前对其检测仍具有很大的挑战性。然而,过去十年技术的进步提供了新的、高灵敏度的方法来揭示现有的微调机制。有几种方法可用于鉴定或量化miRNA的表达,如原位杂交、Northern blotting、定量逆转录聚合酶链反应(qRT-PCR)、微阵列、基于珠状细胞的流式细胞术和小rna测序。虽然其中大多数支持mirna特异性检测,但小rna测序方法提供了通过高通量技术检测所有mirna的唯一方法(Pritchard et al. 2012;Kolanowska et al. 2018)。
尽管人们对脊椎动物视网膜的结构发育进行了长期的研究,但对mirna的了解仍然非常有限。在这里,我们用Ion-Torrent PGM测序技术描述了Wistar WU白化大鼠出生后视网膜的小RNA谱。这些数据为出生后视网膜形成提供了新的见解。此外,由于可能的相似性,我们的结果可能成为发育生物学,特别是其他感觉器官的小RNA研究的有用资源。
方法
动物
动物的处理、饲养和实验程序由passics大学伦理委员会(BAI/ 35/51-58/2016;PTE / 43902/2016)。为了确定实验样本量,进行了g功率分析(附加文件1)。所有的努力都是为了尽量减少疼痛。动物以家庭为单位(雌性+幼崽)/笼子分布,不按性别分开,也没有成年雄性的存在。我们留下了麦克斯。成年大鼠2只1箱(T3-H型,378 × 217 × 180 mm聚碳酸酯箱)。,布达佩斯,匈牙利)。动物维持在12:12 h的明暗循环,并免费提供食物和水。出生日期记为出生后第0天(P0)。随机分为P5、P7、P10、P15、P21组。Wistar WU大鼠在每天同一小时献祭前用Forane(雅培实验室,匈牙利布达佩斯)吸入麻醉,以避免昼夜变化。我们分为5组(P5, P7, P10, P15, P21),采用测序和qPCR两种方法(详见后文)检测这些动物的视网膜发育变化。测序实验采用以下动物数量:P5 n = 3;P7 n = 6;P10 n = 3;P15 n = 3;p21 = 9。测序结束时,生物样本库来源于三个个体的rna。生物复制是指至少有两个不同的生物样本,它们都来源于三个个体的rna。在这种情况下,测序结果最终代表了至少6只动物的miRNA谱,而技术复制来自于在另一个芯片上测序的相同条形码文库。在这种情况下,RNA谱来自相同的三只动物:将它们的RNA汇集在一起用于文库制备,并对该文库进行条形码,然后用于模板制备,最后在ION Torrent PGM Machine的适当芯片上对该模板进行测序。Hackler等人采用了类似的池化方法。用于qPCR验证的动物数量为6只,其中包含用于测序方法的所有样品。每只动物在三个重复中测量。
本探索性研究的目的主要是在视网膜发育的连续时间点中寻找过表达/过表达的小非编码rna。由于我们有相对较少的时间点(3-5),我们处理这个简单的时间过程实验类似于几个组的实验(参见limma, 9.6.1在R统计环境中的指南)。
microrna的隔离
按照制造商的说明,使用NucleoSpin miRNA试剂盒(machery - nagel, d
小RNA测序
根据离子总RNA- seq Kit v2 (ThermoFisher Scientific, MA, USA, Cat: 4475936)协议(Revision E)进行小RNA文库构建(N = 3,每个年龄组),实验过程中受试者采用盲法。酶促反应在一半的反应体积中进行,同时根据协议以准确的最终体积进行清洗程序。
每个年龄组每三个生物重复收集3 μg RNA,并使用磁珠清理模块富集小RNA。从珠上洗脱的小RNA浓缩,在65°C下孵育10 min, 16°C下孵育5 min,然后加入6 μL的连接试剂,在16°C下孵育24 h。
结扎后,在Veriti™96孔热循环器(ThermoFisher Scientific, MA, USA, Cat: 4452300)上进行逆转录(RT):将连接好的RNA样品(10 μL)加入8 μL RT母液,70°C孵育10 min,然后在冰上快速冷却,加入RT酶(2 μL的10× Superscript®III酶),42°C孵育反应(20 μL) 30 min。根据磁珠清理模块的方案纯化RT反应的cDNA,选择大小,用12 μL无核酸酶的水洗脱。
为了扩增cDNA,将纯化后的3 μL cDNA与0.5 μL Ion Xpress™RNA 3 ' Barcode Primer、0.5 μL Ion Xpress™RNA- seq Barcode BC引物(不同样品可选择BC01至BC16, ThermoFisher Scientific, MA, USA, Cat: 4475485)、22.5 μL Platinum PCR SuperMix High Fidelity,反应混合物(26.5 μL)结合,扩增程序如下:94°C, 2min;(94°C 30 s, 50°C 30 s, 68°C 30 s) 2个循环;(94°C 30秒,62°C 30秒,68°C 30秒)16个循环;68°C, 5 min。每个样品的扩增DNA用无核酸酶的水完成到53 μL,样品用磁珠清洗模块纯化,用15 μL无核酸酶的水洗脱。
按照制造商推荐的Agilent Bioanalyzer 2100的高灵敏度DNA芯片(Agilent Technologies, Santa Clara, California, USA, Cat: 5067-4626)检测文库的质量和数量。根据条形码文库的公式:[面积(94-114 bp)] ÷[面积(50-300 bp)]计算miRNA结扎产物占总结扎产物的比例。条形码文库的摩尔浓度在50-300 bp的大小范围内测定,然后按照制造商的方案稀释至~ 20 pM的最终浓度。根据芯片类型,将等量的三个或六个稀释的条形码库组合在一起进行下一步。
模板制备时,使用稀释后的文库(15 μL)生成含有克隆扩增DNA的模板正离子球™粒子(ISPs)。EmulsionPCR (emPCR)在Ion OneTouch™2系统(ThermoFisher Scientific, MA, USA, Cat: 4474779)和Ion PGM™Hi-Q View OT2 200试剂盒(ThermoFisher Scientific, MA, USA, Cat: A29900)上按照推荐的方案进行。模板阳性isp按照制造商的建议使用Ion OneTouch™ES (ThermoFisher Scientific, MA, USA, Cat: 4469495)进行富集。
根据Ion PGM™Hi-Q View测序试剂盒(ThermoFisher Scientific, MA, USA, Cat: 4488149, 4488146)的协议,在Ion Torrent PGM™仪器(ThermoFisher Scientific, MA, USA, Cat: 4462921)上使用Ion 316或318™Chip v2 (ThermoFisher Scientific, MA, USA, Cat: A30044)进行测序。将测序引物和Ion PGM测序试剂盒的Control Ion Spheres™颗粒添加到富集的模板阳性isp中。测序引物退火后,加入测序聚合酶,芯片上最终体积为30 μL。
为了评估316v2芯片中miRNA工作流解决方案的可靠性(如Yao等人,2012),在每个测序程序中,对两个独立的P7样本进行分析(生物重复),并对P21样本进行技术重复测序。部分样品在318 v2芯片(P5、P10、P15和P21)上测序,作为生物重复。
Computatio分析部分
使用Ion Torrent Suite Platform对原始序列数据进行修剪,并去除任何残留在5 '或3 '端的测序适配器片段。使用制造商的PGM、TMAP算法比对工具,将Reads与来自ENSEMBL [Rnor_6.0 (GCA_000001895.4)]的非编码rna进行比对。这些对齐的BAM(二进制对齐图)文件通过Cufflinks, Cuffmerge和Cuffdiff (Version 2.2.1.3)应用程序(Trapnell et al. 2010)在Galaxy web平台(Afgan et al. 2018)中进一步处理。单个转录本的表达量在袖扣中采用FPKM法计算,在袖扣中采用平均片段长度为25的几何文库法计算。使用Pearson相关性来评估生物重复中每个miRNA读取计数之间的相关性。进一步确定最重要的mirna是基于RStudio软件环境(RStudio Team 2015)的统计分析。
使用DIANA miRPath 3.0进行miRNA靶点和通路分析(Vlachos et al. 2015)。实验验证的miRNA靶点使用DIANA-TargetScan进行鉴定,并使用基因联盟选项(一种后验方法)进行途径分析。采用Fisher精确检验和FDR校正进行统计分析。从该工具中导出KEGG数据库中的富集通路以及相应的fdr校正P值。校正后的P值采用显著性阈值FDR = 0.05。
测序结果的验证
TaqMan®MicroRNA assay (ThermoFisher Scientific, MA, USA, Cat: 4427975)用于验证miRNA表达谱。使用TaqMan MicroRNA逆转录试剂盒(ThermoFisher Scientific, MA, USA, Cat: 4366596)根据制造商的说明,从每个年龄组的6个视网膜中分离RNA进行逆转录。最终体积为15 μL,含纯化总RNA 5 μg (10 ng)、10× RT缓冲液、100 mM dNTPs、50 U/μL MultiScribe逆转录酶(MuLV)、20 U RNase抑制剂和3 μL 5×茎环RT引物。反应在Veriti热循环器(ThermoFisher Scientific, MA, USA, Cat: 4452300)中在16°C下孵育30分钟,42°C下孵育30分钟,85°C下孵育5分钟,然后在4°C中保温。然后使用TaqMan通用PCR Master Mix和TaqMan MicroRNA Assay中针对每种miRNA的特异性引物进行RT-PCR。U6小核RNA (U6 snRNA) (ThermoFisher Scientific, MA, USA, assay ID 001973)作为内源性对照。研究的miRNA为miRNA-9 (ThermoFisher Scientific, MA, USA, assay ID 000583)和miRNA-23 (ThermoFisher Scientific, MA, USA, assay ID000399)。在20 μL的PCR反应中,将1.33 μL cDNA加入10 μL的TaqMan Universal PCR master mix II (ThermoFisher Scientific, MA, USA, Cat: 4440043)和1.0 μL的20 × TaqMan mir特异性引物和探针混合物中。使用Step One Plus检测系统(ThermoFisher Scientific, MA, USA, Cat: 4376600),在96孔光学板中95°C孵育10分钟,95°C孵育15秒,60°C孵育60秒,循环40次。阴性对照(无模板)也建立,所有实验都进行三次。相对定量采用2−ΔΔCT方法(Livak and Schmittgen 2001),以P21为参比。
数据的可用性
本出版物中讨论的基因表达谱数据已存放在NCBI基因表达综合数据库中,可通过GEO系列登录号GSE159168访问。
目录
摘要 介绍 方法 结果 讨论 结论 数据可用性 缩写 参考文献 致谢 作者信息 道德声明 补充信息 搜索 导航 #####结果
为了揭示出生后早期视网膜发育过程中主要mirna的定量变化,我们从Wistar WU大鼠视网膜5个发育阶段(P5, P7, P10, P15, P21)中提取总RNA样本。为了监测提取的RNA样品的总体质量,使用Agilent生物分析仪软件计算RIN。高质量和低降解样品(RIN≥7)只能进一步处理。为了评估实验程序在316 v2芯片上的可重复性,我们对两个独立的P7样品(生物重复)进行分析,并对P21样品在每个测序程序中作为技术重复进行测序。两个独立的P7组织样本和每个P21样本之间的miRNA水平具有较高的Pearson相关系数(Pearson r分别为0.92和1.00),这意味着测序的高重复性(图1A)。部分样品在318 v2芯片(P5、P10、P15和P21)中测序;作为生物复制),也具有较高的Pearson相关系数(图1B)。结果取平均值以减少实验误差。在316 v2芯片中,我们共获得143,796,965个碱基,去除低质量reads和污染物后,每个样本平均获得12,182,661个reads,每个样本的峰值长度约为24 nt(附加文件2)。
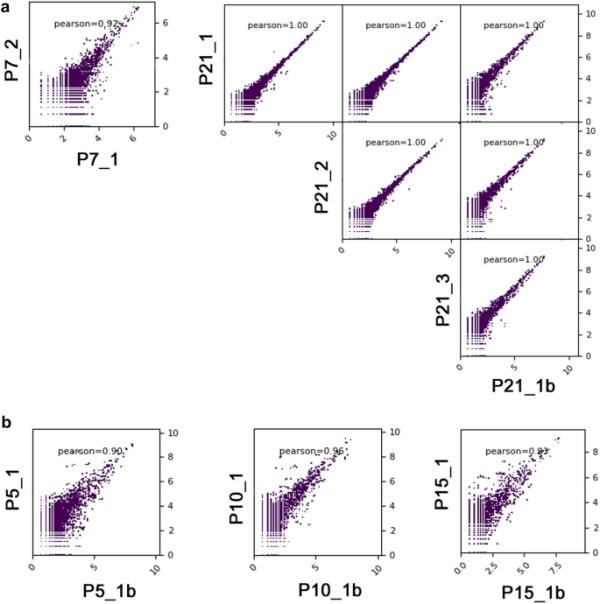
所有样本中全球miRNA表达谱的Pearson相关系数。A技术复制,B生物复制
根据序列映射到褐家鼠参考文献ENSEMBL (Rnor_6.0 (GCA_000001895.4))的RNA reads进行注释(平均420 178 reads/样本),并根据其计数确定其相对丰度,归一化到RPKM方法的数量。为了尽量减少假阳性信号,仅使用在316和318 v2测序(生物和技术重复)中检测到的reads进行进一步的生物信息学分析。主成分分析(PCA)揭示了基于出生后发育日期的部分分离样本,如附加文件3所示。
根据ENSEMBL的非编码RNA分类方法,我们将测序产生的数据分为功能重要的五类,包括核糖体RNA (RNAs),以及小RNA,如microRNAs、snoRNAs和snrna(表1)。
众所周知,rRNA在蛋白质合成机制中起着重要的作用,在P10和P15的比较中,rRNA数量最高为97,最低为91。参与rna生物发生或参与蛋白质合成的小rna的总表达水平,在发育期间主要表现为相同的趋势。P10位点非编码rna数量的轻微减少提示其在视网膜突触发生中具有重要的蛋白质合成调节作用。
关注来自ENSEMBL的非编码rna中的已知mirna,我们确定了大约272个mirna在五个发育阶段中的至少一个阶段。mirna的表达谱可以为它们在发育过程中的潜在功能提供指示。我们观察到,虽然在发育过程中视网膜中检测到的mirna总数没有明显差异,但不同阶段视网膜中不同mirna的表达水平是非常动态的(图2)。表2收集了各发育阶段中最丰富的mirna。
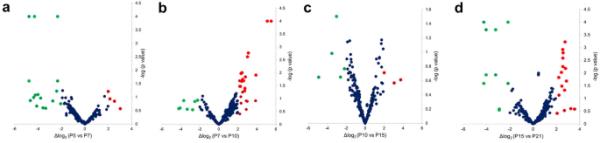
Wistar大鼠视网膜连续时间点差异表达mirna的火山图。A出生后5天(P5) vs出生后7天(P7), B P7 vs P10, C P10 vs P15, D P15 vs P21。红色圆圈表示上调的mirna,绿色圆圈表示下调的mirna(双重变化)。x轴表示log2尺度上的表达水平差异,y轴表示负对数尺度上对应的P值(学生t检验);更多的横向点和更高的点分别意味着更广泛和统计上显著的差异。全彩色点(红色或绿色)表示p值小于或等于0.05
在连续时间点收集差异表达的mirna, P < 0.05(附加文件4)。有趣的是,只有P5与P7和P10与P15的下调mirna达到截止值,而P7与P10的上调mirna主要被检测到。有一些mirna在发育过程中表现出恒定的高丰度,如miR-19、miR-101;miR-181, miR-183, miR-124和let-7。虽然有些mirna仅在早期阶段出现最丰度,如miR-20a、miR-206、miR-133b、miR-466、miR-1247或miR-3582,但其他mirna在后期具有高丰度或随着发育而增加,如miR-29b、miR-96、mir-125、miR-344或miR-664。
为了通过定量聚合酶链反应(qPCR)进一步验证测序结果,我们选择了miR-9和miR-23,根据我们之前的调查和文献检索,它们似乎在出生后视网膜发育中具有重要意义(Leucht et al. 2008;Arora et al. 2010;高2010;La Torre et al. 2013;气2016;Pöstyéni等人,2021a, b)。与P21相比,miR-9的相对表达水平呈现上调模式,mir-23的相对表达水平呈现下调模式。此外,qPCR显示的miRNAs表达模式与测序结果基本一致(图3),也有一些例外。例如,P5和P7处的miRNA-9或P15处的mir-23,当测序结果显示与P21相比下调时,而qPCR数据显示轻微上调。尽管qPCR和深度测序结果之间存在这些微小差异,但我们的数据在检测和定量mirna的相对表达水平方面具有高度相关性和准确性。
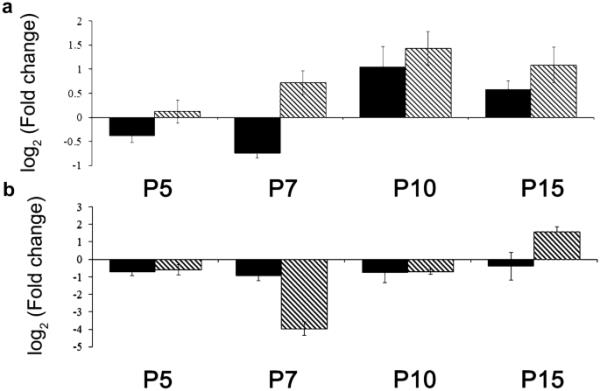
rno-mir-RNA测序(黑色)与qPCR(条纹)的比较结果。A出生后视网膜发育过程中发现的rno-mir-9和rno-mir-23水平的Fold变化(平均值±SEM) (Pöstyéni et al. 2021a, B)
预测与功能差异表达miRNA靶基因的nal分析
为了深入了解差异表达的mirna在视网膜出生后发育中的作用,使用DIANA网络工具预测潜在的靶基因并应用途径富集分析。这种富集分析确定了至少一个选定的miRNA靶向的所有基因的基因显著富集的途径。对于差异表达的mirna, 850个预测的靶基因被注释了功能。重要的是要知道,每个miRNA可以有不同的靶标,不同的miRNA可以有相同的靶基因。在log2倍变化值大于或小于±1.5 (P < 0.05)的富集途径中,被切断的miRNAs所靶向的途径有:脂质代谢(如不饱和脂肪酸、花生四烯酸或甘油磷脂)、氨基酸代谢(如缬氨酸、亮氨酸、异亮氨酸或溶酶降解、酪氨酸代谢)和大量的聚糖代谢。P5-P7转换的数据集显示了在谷氨酸突触形成中的关键作用(附加文件5)。在显著下调的miRNAs rno-miR-30c1和2中,rno-miR-205和rno-miR-503被检测到靶向Prkx (ENSRNOG00000003696)、Adcy6 (ENSRNOG00000011587)、Gnai3 (ENSRNOG00000019465)和Homer2 (ENSRNOG00000019297)基因,如图4所示。此外,P5-P7转换的数据分析也揭示了在间隙连接(rn04540) KEGG通路中的重要性(附加文件5)。除了Prkx (ENSRNOG00000003696)、Adcy6 (ENSRNOG00000011587)和Gnai3 (ENSRNOG00000019465)基因外,Gja1 (ENSRNOG00000000805)在该通路中表现出强烈的影响(图5)。这些结果表明mirna在调节细胞代谢中的作用。突触形成(化学和电)以及增殖/生存/迁移过程参与视网膜发育过程。
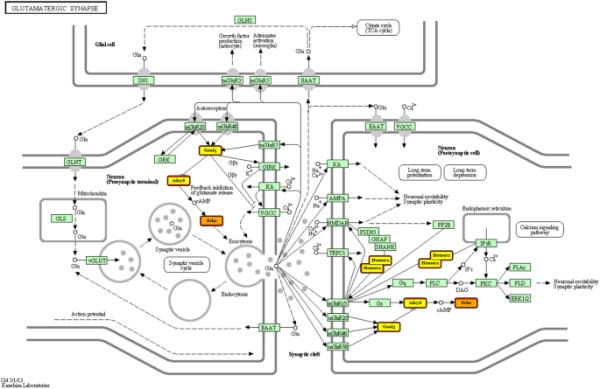
谷氨酸突触通路流程图。重点介绍了通过IonTorrent PGM测序鉴定的mirna靶向的基因。被多个miRNA靶向的基因用橙色表示,而被单个miRNA靶向的基因用黄色表示。Prkx (ENSRNOG00000003696), Adcy6 (ENSRNOG00000011587), Gnai3 (ENSRNOG00000019465)和Homer2 (ENSRNOG00000019297)
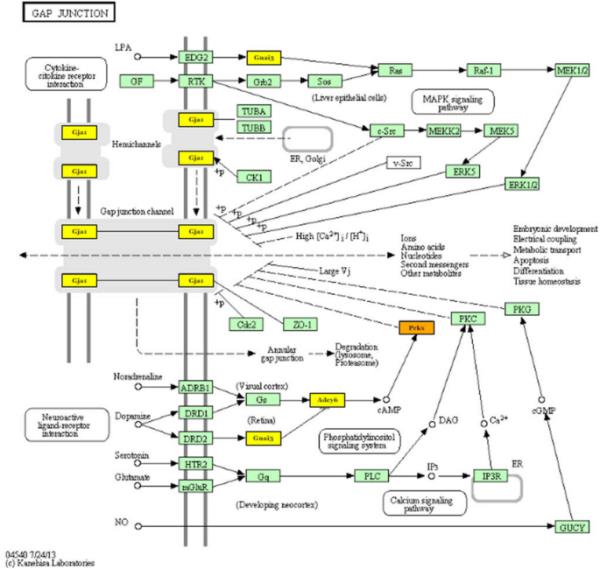
间隙连接突触通路流程图。重点介绍了通过IonTorrent PGM测序鉴定的mirna靶向的基因。被多个miRNA靶向的基因用橙色表示,而被单个miRNA靶向的基因用黄色表示。Prkx (ENSRNOG00000003696), Adcy6 (ENSRNOG00000011587), Gnai3 (ENSRNOG00000019465)和Gja1 (ENSRNOG00000000805)
讨论
目前,测序产生了越来越多的数据,特别是在视网膜miRNA水平上了解基因表达调控。然而,关注正常发育事件的研究数量有限,仅旨在揭示mirna在基因调控网络中的微调作用(Xiang 2013;Xu et al. 2007;Georgi and Reh 2010;Arora et al. 2010;Torre et al. 2013;Coolen et al. 2013;Kapsimali et al. 2007)。众所周知,mirna对包括视网膜在内的中枢神经系统的生理和发育过程至关重要(Sundermeier和Palczewski 2012;Maiorano and Hindges 2012;高2010;Hackler et al. 2010;Linsen et al. 2010)。在这里,我们分析了出生后发育过程中Wistar白化大鼠视网膜组织中miRNAs的表达,我们发现miRNAs表现出广泛的表达模式多样性。其中一些似乎在第一天优先富集,如rno-mir-20a、rno-mir-133、rno-mir-206、rno-mir-466c,而另一些则在后来的日子里表现出更高的富集度,这表明在控制晚出生的视网膜细胞(视杆光感受器、双极细胞和Muller胶质细胞)的发育以及维持视网膜神经元和/或Muller胶质细胞(例如rno-mir-29、rno-mir-96、rno-mir-125、rno-mir-344)中发挥了不同的作用。其他mirna也显示出持续的高富集度,如let-7作为与视网膜靶点相关的最高表达的rna mirna (CLASP2、DMD、DUSP1、ELOVL4、NLK、FZD4、RB1、RDH10、RGS16、SLC25A18;Arora et al. 2007)。
目前仅有有限的研究能够全面描述rno-miRNA在啮齿类动物眼中的时空表达。他们揭示了视网膜中一些rno- mirna的细胞类型特异性富集,如rno-mir-29c、rno-mir-30d、rno-mir-96、rno-mir-99b、rno-mir-124a;优化- mir - 182;优化- mir - 183;优化- mir - 184;成年小鼠外核层杆状和锥状光感受器Rno-mir-381和rno-mir-425。其他的(rno-mir-409-5p、rno-mir-433、rno-mir-541和rno-mir-742)显示无特异性染色(Karali et al. 2010)。该rno-mir-Neye图谱测定了成年小鼠眼睛晶状体、角膜和视网膜色素上皮中rno-miRNAs的表达谱。然而,当我们制作视网膜总细胞提取物时,除了rno-mir-29c外,我们可以检测到大多数;优化- mir - 182;Rno-mir-409-5p和rno-mir-742。rno-mir-184仅在P5时检测到有意义的量。
此外,let-7、rno-mir-125和rno-mir-9在发育中的小鼠视网膜中发挥重要作用,调节从早期到晚期视网膜祖细胞的转变(Andreeva和Cooper 2014)。
其他研究强调了rno-mir-183/96/182簇作为感觉器官特异性rno-miRNA的重要性。所有这三种mirna具有相似的发育表达模式,并转录为单一的多顺反子转录物。这些mirna的感觉器官特异性也得到了上游CpG岛的序列分析的支持,CpG岛含有多个预测的转录因子结合位点,这些位点是神经感觉细胞中表达的基因的特征,如OTX1, Pou3F2或Pax5 (Xu et al. 2007;Coolen et al. 2013)。与这些研究非常一致的是,我们发现在出生后第10天,rno-mir-183/96/182急剧增加。我们已经提到,我们能够检测到rno-mir-183和rno-mir-96,但有趣的是,没有检测到rno-mir-182。
我们的研究结果也与基于芯片的C57BL/6小鼠眼内microRNA表达的研究基本一致,在野生型动物发育过程中,rno- mirna的表达有上升或下降的趋势[例如,rno-mir-20的表达下降;rno-mir-29或rno-mir-125升高[Hackler et al. 2010]。然而,与Hackler et al.(2010)的研究结果相比,存在一些差异。而在我们的研究中,rno-mir-16表现出持续的高表达,并有轻微的变化(即从P5到P7略有下降,然后在P10达到峰值,之后又略有下降到P21),在发育中的C57BL/6小鼠视网膜中,这种rno-miRNA显示出下降的趋势。同时,在野生型小鼠中检测到rno-mir-30的表达模式增加,我们对出生后天数的详细时间尺度能够检测到波动的轮廓:在P7时趋于最小,之后急剧增加到P15,最后在P21时再次下降。最后,在我们的研究中,rno-mir-103被评估为具有逐渐增加的特征,而在发育中的C57BL/6小鼠视网膜中甚至没有提及。
为了更好地理解mirna的作用,mirna -靶标相互作用被揭示出来。DIANA网络工具发现了它们在各种生物过程中的作用。从视网膜发生的角度来看,我们所有的研究中P5-P7转变的数据集似乎是最令人兴奋的。虽然神经视网膜和视觉系统的发育,特别是突触发生是复杂的,但研究表明,主要事件对应于一个特殊时期发生(Rapaport et al. 2004;瑞茜2011;Bassett and Wallace 2012;Hoon et al. 2014;Kapsimali et al. 2007)。
我们的P5-P7过渡数据集似乎强调了mirna在谷氨酸突触和间隙连接形成中的可能作用。正如我们之前提到的,此时视网膜发生了显著的变化。通过神经母细胞层细胞的重排形成OPL (Bagnoli et al. 2003;Amini et al. 2018),同时也观察到
虽然我们的研究预测的大多数潜在靶基因(Prkx, Adcy6, Gnai3, Homer2)在文献中没有数据,但基于有限的研究表明它们在各种组织特别是嗅觉系统的发育过程中发挥重要作用,我们认为它们在视网膜形成中起重要作用(Li et al. 2005;Azaiez et al. 2015;Huang et al. 2016;Guo et al. 2017;Beer-Hammer等人,2018)。最后,Gja1[也被称为connexin43 (Cx43)]是中枢神经系统中最丰富的间隙连接蛋白,主要在星形胶质细胞和突触细胞上表达,因此负责维持局部稳态(Kerr et al. 2010;Völgyi et al. 2013)。
结论
这里描述的数据集将是深入了解视网膜发育过程中基因调控网络的宝贵资源。众多基因参与视网膜的形成和分化,被各种mirna靶向,从而形成一个复杂的调控网络,以特定阶段的方式引导视觉系统的发展。因此,这些数据为研究在特定发育阶段,特别是在P5-P7过渡阶段的跨发育表达或药物操作的影响提供了有用的框架。
补充信息
以下是电子补充材料的链接。


