摘要
建立了一种高效液相色谱-三重四极杆质谱仪(UHPLC-QqQ)同时分析土壤、堆肥和动物粪便样品中24种抗菌素的方法。为此,对聚焦超声固液萃取(FUSLE)和QuEChERS两种提取技术(快速、简便、廉价、有效、坚固、安全)的提取效果进行了评价,并对固相萃取(SPE)的清理步骤进行了深入研究。方法在10 μg·kg−1、25 μg·kg−1和50 μg·kg−1条件下均成功验证,除少数例外情况外,准确度(70 ~ 130%)和重复性(RSD < 30%)良好。测定了土壤、堆肥(0.45 ~ 7.50 μg·kg−1)和粪肥(0.31 ~ 5.53 μg·kg−1)样品的定量程序限(LOQPRO)。当LOQPRO≥10 μg·kg−1时,培氟沙星无法在最低水平进行验证。土壤样品中检测到磺胺乙嘧啶(7.9±0.8µg·kg−1)、丹氧氟沙星(27.1±1.4µg·kg−1)和甲氧苄啶(4.9±0.5µg·kg−1);研究土壤样品表面生长的植物中含有四环素(56.8±2.8µg·kg−1)和其他抗菌素。同样,羊粪中磺胺类(SAs)、四环素类(TCs)和氟喹诺酮类(FQs)的含量范围为1.7±0.3 ~ 93.3±6.8µg·kg−1。土壤和粪便样品也通过UHPLC耦合高分辨率质谱仪(UHPLC- qorbitrap)进行分析,以将多靶点方法扩展到筛选超过22,281个可疑分子。在粪便样品中,磺胺乙嘧啶(甲酰基-磺胺乙嘧啶)的特异性转化产物(TP)为2a水平。这项工作有助于在过去十年中开发分析方法,允许对各种抗菌剂进行多靶点分析,包括TPs,由于抗菌剂的不同物理化学性质,这是一项复杂的任务。
介绍
随着人口的不断增长,需要制定不同的可持续农业战略来满足不断增长的粮食需求[1]。从这个意义上说,为了在提高作物产量的过程中减少矿物肥料的使用,增加了有机肥的使用,如动物粪便和粪便基堆肥[2,3]。粪肥被认为是一种非常有价值的肥料,因为它含有植物生长所必需的营养[4]。然而,集约化畜牧业中大量使用药物,特别是抗菌剂来对抗细菌感染,导致人们认为动物粪便和衍生堆肥是抗菌剂进入土壤环境并随后在植物中积累的重要途径[4,5,6,7]。不同的科学工作报道了世界各地动物粪便中残留抗菌素的发生,这是这些药物代谢不完全和部分吸收的结果[8,9,10,11,12,13]。
有关肥料和土壤中抗菌剂的立法缺乏,使这一问题更加严重。与法规最接近的细节是欧洲药品评估机构提供的指导说明,其中指出,用于土地施用的肥料中药物残留含量不得超过100 μ g·kg - 1,施用肥料的土壤中药物残留含量不得超过10 μ g·kg - 1[12,13,14]。
然而,与环境中药物存在相关的主要问题是抗菌素耐药性的传播[5,9],因为它可能导致目前可用的抗菌素对常见感染无效[6],对人类健康构成潜在威胁。即使在粪肥和土壤中检测到低浓度(即μ g·kg−1水平)的抗菌素[14],低浓度也足以引起细菌基因组的遗传变化,因此土壤中的细菌可能代表可转移给人类病原体的抗性基因储存库[10,15]。此外,抗菌剂在不同的光照、湿度和温度条件下往往会降解[10,16],从而形成各种转化产物(TPs),其中一些转化产物的毒性比母体化合物更大[17]。到目前为止,人们对TPs是否参与耐药性的产生知之甚少;因此,为了进行全面的风险评估,开发分析方法来检测微量抗菌剂和监测粪便、堆肥(在被认为适合土壤施用之前)和土壤中TPs的形成是至关重要的。
虽然有几种分析方法旨在分析生物固体中的有机污染物,但涉及抗菌分析的分析方法是近年来才发展起来的。在这些方法中,液相色谱串联质谱法(UHPLC-MS/MS)是最常用的抗菌药物定量分析技术[18,19],但使用了不同的样品处理方法。通常,抗菌剂的提取方法包括超声辅助溶剂萃取(USE)[20]、聚焦超声固液萃取(FUSLE)、加压液体萃取(PLE)[21,22]或微波辅助萃取(MAE)等[18]。最近,QuEChERS[23](快速、简单、廉价、有效、坚固和安全)是一种小型提取和清理技术,由于它允许进行高通量分析,在时间和实验室资源节省方面显示出优势,因此引起了人们的兴趣。无论采用何种提取方法,提取液通常都要经过一个清理步骤,以消除或最小化可能的基质干扰。清理步骤通常通过固相萃取(SPE)进行,使用Oasis亲水-亲脂平衡(HLB)或强阴离子交换(SAX)[11,20,24,25]等吸附剂。
然而,由于抗菌素的理化性质不同,很难在一次运行中同时进行分析,因此需要使用特定的方法对每组进行分析。近年来,一些工作集中在开发方法,允许同时分析土壤和粪便中的这些化合物。其中一些方法包括同一科或有限几个科的少数同系物的选定抗菌素。例如,Barron等人报道的方法是先进行PLE萃取,然后进行SPE净化。[26]仅在土壤中三种抗菌剂的分析中得到验证。同样,Meng等人[27]开发的另一种基于quechers的方法仅涵盖磺胺类(SAs)和大环内酯类(MCs)的分析。其他方法包括大量使用抗菌素;但是,在其中一些情况下,条例的准确性要求没有得到充分满足。Martínez-Piernas等人[23]开发的基于quechers的方法就是这种情况,该方法在抗菌素方面仅达到了三种MCs和甲氧苄啶的准确性和精密度要求;或在da Silva等人所做的工作中,在广泛研究的抗菌素清单中,它显示出一些准确性问题,特别是氟喹诺酮类药物(FQs)和四环素类药物(tc)[28]。
在此背景下,本工作旨在建立一种同时分析动物粪便和土壤堆肥样品中5种sa、4种tc、6种FQs、4种mc、1种二氨基吡啶(DP)、霉酚酸(从stoloniferum中分离的化合物)和3种抗真菌化合物(AFs)的高效液相色谱-质谱联用方法。如上所述,非人类使用抗菌剂会影响耐药细菌的发生,从而影响人类对它们的接触。据报告,当病原体对对人类健康至关重要的抗微生物药物具有耐药性时,这种接触的后果尤为严重。因此,在这项工作中,研究了世界卫生组织(WHO)分类为对人类医学至关重要或高度重要的抗菌素[29]。比较了FUSLE和基于quechers的盐析提取技术,并对SPE的净化步骤进行了全面评估,以获得灵敏度和准确性的最佳条件。此外,该方法还扩展到使用高分辨率质谱进行可疑分析,以测定更多的抗菌素和可能的TPs。这些方法分别用于分析来自不同奶酪生产商和当地农场的25种土壤、24种植物、7种羊粪和9种马粪样本。
实验的程序
试剂和材料
目标抗菌剂和替代标准的分布和特定物理化学性质收集在表S1中。每个月以1000-3000 mg·kg−1的浓度在超高效液相色谱质量甲醇(MeOH, 99.9%, Scharlau, Sentmenat, Catalonia,西班牙)、超高效液相色谱质量乙腈(ACN, 99.9%, Avantor Performance Materials, Gliwice, Silesia,波兰)或二甲基亚砜(DMSO, Panreac AppliChem, Darmstadt,德国)中配制单个溶液(见表S1)。在FQs的情况下,将标准品单独溶解在相应的溶剂中,并加入3滴NaOH 2m溶液(99%,Merck, Darmstadt, Hesse, Germany),以制备浓缩原液[30,31]。每周在ACN中制备中间100 mg·kg−1、5 mg·kg−1和1 mg·kg−1混合溶液。浓度最高的溶液保存在-20°C, 5 mg·kg−1和1 mg·kg−1的混合物保存在4°C。所有工作标准溶液制备并储存在硅烷琥珀小瓶中,以避免光降解[32]。提取盐采用PanReac AppliChem公司(Castellar del valls, Catalonia, Spain)的NaCl(100%)、Scharlau公司的无水柠檬酸H3Cit(99.5%)、Scharlau公司的无水Na2HPO4(98%)和Merck公司的无水Na2SO4(99%)。萃取剂采用uhplc级MeOH和ACN以及由无水NaH2Cit(99%)和Na2HCit·1.5H2O(99%)水溶液组成的柠檬酸缓冲液(Honeywell Fluka, Charlotte, North Carolina, USA)。用Na2HPO4 (98%, Scharlau)和来自PROBUS (100%, C. Busquets, Badalona, Spain)的NaH2PO4配制磷酸盐缓冲液,在清理前进一步稀释和调整提取液的pH值。在清理方面,使用了从Waters (Milford, Massachusetts, USA)购买的Primary - Secondary Amine (PSA)、Bondesil-C18 (40 μm, Agilent Technologies, Santa Clara, CA, EEUU)和石墨化炭黑(GCB) (37-125 μm, Superclean env - carb, Merck)吸附剂和Oasis HLB滤盒(200和500 mg, 6 cc, 30 μm)。草酸(100%,默克)用于最终的提取物重构。
样品处理过程使用Heidolph (Schwabach, Bavaria, Germany)的Multi - Reax摇床和Eppendorf (San Sebastián de Los Reyes, Madrid, Spain)的5840R离心机。
土壤、肥料和植物样本
在Nafarroa、Araba、Bizkaia和Gipuzkoa(巴斯克地区)的Idiazabal cheese P.D.O.的四个不同的奶酪生产商附近收集了25个土壤样本。取样的土壤是牧场,牧场上施用了动物粪便,绵羊在牧场上吃草。羊的数量因生产者而异,但平均在400到600只之间。每个地点随机采集6个样本(尺寸为30 × 30 × 30 cm)。对土壤表面(从每个收集到的土壤组分中)存在的不同植物种类也进行了汇编。另一份土壤样本取自Neiker研究中心(西班牙巴斯克地区比斯开)。样品保存在拉链袋中,到达实验室后在- 80°C冷冻。
至于粪便样本,羊粪是从属于Idiazabal奶酪P.D.O.的四个不同的奶酪生产商收集的,土壤样本是在那里采集的。在每个地点,在连续两周内收集了两个样本,除了纳法罗阿生产者,他们只收集了一个样本。此外,亦从一间本地农场供应商处收集了九份马粪样本。所有粪便样品保存在拉链袋中,并在- 80°C冷冻直至分析。
样品的预处理和提取
研究比较了两种不同的提取策略:QuEChERS和FUSLE。首先用无抗菌土壤:堆肥(97.25:2.75,w:w)样品对两种方法进行了评价,然后将最佳方案也用于粪便中抗菌药物的测定。
植物样品的提取采用了一种改进的分析方法,该方法基于课题组先前开发的QuEChERS提取方法(见补充资料)[33]。
QuEChERS
根据课题组在之前的工作中建立的初始条件对QuEChERS协议进行了优化[33]。简单地说,5 g新鲜且均匀的土壤:堆肥混合物,加入50µL 5 mg·kg−1的原液(在提取前在黑暗中保持至少30分钟),用2 mL mL mL mL mL mL ACN, 4 g无水Na2SO4(而不是MgSO4,因为它释放的能量可能会影响被测药物的稳定性)和1 g NaCl提取。根据文献[35]中观察到的pH值评估提取液的pH值。分别以0.5 g无水H3Cit、0.1 g乙酸钠和1.25 g乙酸钠与0.05 g无水Na2HPO4混合,分别得到pH为2.5、pH为4和pH为7.5的pH值,考察不同pH值下的萃取效率。将陶瓷均质器添加到混合物中,然后手动摇动并脱气,直到没有气体释放。所有样品最终在10-15°C下进行涡旋(2000 cycles·min−1,8 min)和离心(4000 cycles·min−1,5 min)。
采用最佳土壤条件:堆肥样品(pH值为2.5)提取粪便中的抗菌剂。由于粪便中有机物含量较高[18],为了保持与土壤:堆肥样品相同的样品/萃取剂比例,取2 g新鲜粪便,分别使用760µL milliq水、5 mL ACN、2 g无水Na2SO4、0.5 g NaCl、0.25 g无水H3Cit和0.025 g Na2HPO4进行萃取。
FUSLE
干燥土壤:对添加10µg·kg−1浓度水平的堆肥样品(0.5 g)进行分析,以比较FUSLE和QuEChERS提取方法。提取时,加入7 mL的MeOH,根据课题组经验,提取时间为2 min,提取幅度为20%,提取时间为2 min(每秒提取0.8 s开0.2 s关)[36,37,38]。然后将样品在10°C和10,000次·min−1下离心12分钟。
清理过程
无论采用何种提取程序,在UHPLC-MS/MS分析之前都需要对提取物进行清理。为了达到这一净化目的,采用了固相萃取技术。
在土壤:堆肥基质的情况下,优化了几个SPE因素:(i)吸附剂的量(200或500 mg)和提取物的装载量(3.5 mL用柠檬酸缓冲液(0.05 mol·L−1,pH 4)稀释到70 mL,或7ml在500 mg稀释到140 mL)和(ii)提取物的pH (pH 4或pH 7.5)。在最佳条件下,分离3.5 mL提取物,稀释至70 mL,装入200 mg Oasis HLB培养皿中,用5 mL ACN, 5 mL milliq水和5 mL柠檬酸缓冲液(pH = 4)进行预处理。一旦稀释的萃取物完全装入后,用5ml水清洗墨盒并在真空下干燥,并用9ml ACN洗脱化合物。随后,提取液在氮气流TurboVap LV蒸发器装置(Caliper Life Sciences, Hopkinton, MA, USA)中蒸发至1ml。在250µL的50:50 (v:v) ACN:草酸(aq, 0.01 mol·L−1,pH 2)溶液中重组125µL,通过0.22µm聚丙烯过滤器(clarity - pp, Phenomenex, Torrance, CA, USA)过滤,然后进行UHPLC-MS/MS分析。
考虑到粪便中有机质含量高于土壤,本实验采用500 mg Oasis HLB滤池进行清理步骤,并评估样品上样量(1 mL用柠檬酸缓冲液(0.05 mol·L−1,pH 4)稀释至20 mL或2 mL稀释至40 mL)。在最佳条件下,将2 mL粪便提取物用柠檬酸缓冲液(0.05 mol·L−1,pH 4)稀释至40 mL,装入500 mg Oasis HLB培养皿中,培养皿事先用10 mL ACN、10 mL milliq水和10 mL柠檬酸缓冲液进行调节。随后的洗脱、蒸发和重构步骤按照前面对土壤堆肥样品的解释进行。
UHPLC-MS / MS分析
与课题组之前的工作一样进行色谱分离[33]。简单地说,使用Agilent 1290 Infinity II UHPLC装置(Agilent Technologies),使用Kinetex C18 polar 100 Å (2.1 × 5 mm, 2.6 μm)预柱和Kinetex C18 polar 100 Å (2.1 × 50 mm, 2.6 μm)柱(Phenomenex, Alcobendas,西班牙)。采用Agilent Technologies公司的Agilent 6430三重四联质谱计(QqQ)作为质谱分析仪,采用动态多反应监测(DMRM)采集模式进行定量分析。电喷雾电离源对所有分析物均工作在正模式(ESI +)。表S2总结了目标分析物和代物的破碎电压(V)、碰撞能量(eV)以及母离子和产物离子(m/z)。
QA/QC和物料清洗程序
为了克服可能在假阳性检测中产生的背景污染问题,在分析过程中使用的所有材料都被彻底清洁。简单地说,非重复使用的玻璃试管在马弗炉(HD-230, Hobersal, Caldes de Monbui, Catalonia,西班牙)中350°C加热一小时。然后,用5% (w/w)二水乙二胺四乙酸二钠(Na2EDTA, 100%, PanReac AppliChem)水溶液在超声浴(J. P. SELECtA, Abrera, Catalonia,西班牙)中洗涤,以避免目标分析物与玻璃表面上的硅醇基团可能的相互作用[35,39,40]。清洗干净的试管用milliq水冲洗和超声,并在100°C下干燥。先用milliq水对陶瓷均质器进行超声处理,然后用二氯甲烷对陶瓷均质器进行超声处理。最后,在使用前将它们在350°C下加热一小时。对于塑料材料,将其全部浸入10% HNO3 (69%, Merck)浴液中48 h,用milliq水冲洗并在50°C下干燥后使用。
根据Eurachem指南[41]和法规(EU) 2021/808[42]中描述的标准,从绝对回收率和表观回收率、可重复性的精度以及定量的仪器和程序限制方面评估了该方法的有效性。根据理事会指令96/23/EC[43]中建立的鉴定标准对样品中的目标分析物进行色谱鉴定。通过与参考标准的保留时间比较以及每个目标化合物的两个最特异过渡的存在,证实了化合物的存在。在两种固体样品的检测中,使用萃取物在色谱分析之前加标目标化合物来评估基质效应。使用基质匹配校准和标记化合物作为替代方法来校正绝对回收率和表观回收率计算。虽然这两种策略都适用于本方法中包含的所有分析物,但最优策略被理解为在每种情况下给出70到130%的值。关于替代品的选择,为每个抗菌药物家族选择一个标记的类似物。
最后,在每个优化和样品分析实验中,至少包括三个空白样品(带和/或不带基质),并使用与加标样品相同的分析程序进行处理。
UHPLC-q-Orbitrap分析及可疑筛选
土壤和粪便样品也通过Thermo Scientific Dionex UltiMate 3000 UHPLC与Thermo Scientific Q Exactive Focus四极轨道rap质谱仪(UHPLC- Q - orbitrap)进行分析,该质谱仪配备了加热ESI源(HESI, thermofisher Scientific, CA, USA),以扩大多靶点方法的范围,以筛选超过22278个可疑对象。简单地说,提取液被注射到ACE UltraCore XB-C18 (2.1 mm × 150 mm, 1.7µm)色谱柱上,柱上有Phenomenex公司的预过滤器(2.1 mm ID, 0.2µm)。关于流动相,milliq水(A)和MeOH (B),都含有0.1%的HCOOH,在正电离模式下使用。流速为0.3 mL·min - 1,柱温为50℃,进样5µL,自动进样器保持在5℃。所有样品一式三份注射。q-Orbitrap以完全依赖扫描数据的MS2 (full MS-ddMS2)发现获取模式运行。数据依赖的强度阈值和动态排除分别为8.0 × 103,自动设置。扫描范围为m/z 70-1050, Full MS对200 m/z关系的分辨率为70,000 FWHM,随后是3次ddMS2扫描,分辨率为17500 FWHM,隔离窗口为3 m/z。高能碰撞解离(HCD)电池的阶跃归一化碰撞能量(NCE)设为10-30-70 eV, MS2为不同能量下得到的碎片之和。HESI源参数设置为喷雾电压3.8 kV,毛细管温度360°C,鞘气(氮气)40任意单位(au),辅助气体15 au,辅助气体加热器310°C, s透镜射频电平设置为55.0。使用Pierce LTQ ESI校准解决方案(thermofisher Scientific)每3天对仪器进行外部校准。Xcalibur 4.0 (thermofisher - scientific)用于控制色谱和质谱系统。
对于可疑筛选,使用Compound Discoverer 3.3 (thermofisher Scientific)软件。在选峰标准上,只有峰面积最小为500000且峰形符合Lorentzian的特征才会被人工挑选出来进行进一步标注。使用9个不同的质量列表,只考虑误差小于±5 ppm的精确质量,其中5个是由BioTransformer 3.0软件获得的代谢转化产物(19,483个化合物),另外4个包括来自不同家族的抗菌剂和tp(2795个化合物),总计22278个化合物。如果MS1光谱匹配满意(SFit > 30%,同位素剖面> 80%),则考虑化合物发现者建议的分子式进行注释,并建立5e5个单元的最小考虑峰。各组(注射重复)变异系数(CV)均小于或等于30%,峰值大于空白10倍,注射重复内相对标准偏差(RSD %)小于30%。此外,由于含有O, N, Cl, Br, S和/或F原子的特定抗菌分子,它仅限于含有这些原子的分子。以ACN空白为参考进行消噪,只考虑质量列表中包含的特征。当MS2可用时,将其与mzCloud数据库(http://k1.fpubli.cc/file/upload/202308/31/zq4ytt2cfo5)中的对应光谱进行比较。并考虑70%的阈值为阳性识别。还使用mzLogic工具(thermofisher Scientific)评估碎片,并考虑最小阈值为60%。留存时间从留存时间指数(RTI)平台(http://rti.chem.uoa.gr/)估计,根据与所建模型不确定性内的估计值是否存在统计学差异(仅考虑框1和框2候选人),候选人被拒绝或接受。采用Schymanski[44]量表对确定的候选人进行1 - 3级识别。在第3级,存在提供可能结构的证据,但只有一种确切结构(例如位置异构体)的信息不足,因此提出了暂定的候选物质。相反,在第1级和第2级中,结构是确定的。它们之间的区别在于,在第1级中,结构是通过MS、MS2和保留时间匹配的参考标准的适当测量来确定的,而在第2级中,在没有标准或实验MS2数据库可用的情况下,使用不同的证据提出可能的结构,例如MS2库匹配(2a级)或硅片中的诊断MS2 (2b级)。
目录
摘要 介绍 实验的程序 结果与讨论 方法应用 结论 参考文献 致谢 作者信息 道德声明 补充信息 搜索 导航 #####结果与讨论
注射溶剂
对于进样溶剂的选择,参考了前人基于SAs和tc色谱分析的研究[33]。在这项工作中,不同的有机溶剂(ACN和MeOH)及其水溶液混合物作为注射溶剂进行了评估,得出ACN:草酸(50:50,v:v) (aq, 0.01 mol·L−1,pH 2)在色谱分辨率和TCs的外显异构避免方面的最佳选择。因此,对ACN:草酸混合物进行了测试,以分析本工作中包括的其他抗菌剂。图S1-S4为所评价的注射溶剂中每组代表性抗菌药物的色谱图。可以看出,ACN:草酸混合物为目标抗菌剂恢复了足够的分辨率和峰对称性,因此,它可以用于进一步的实验。
提取优化
FUSLE vs QuEChERS
根据每个方案中回收的分析物数量及其绝对回收率来评估FUSLE和QuEChERS (pH值2.5)的充分性。为了进行评估,使用两种方法提取加标(n = 4)土壤:堆肥样品和非加标(n = 4)土壤:堆肥样品,并使用SPE对提取物(稀释至70 mL并用柠檬酸缓冲液调整pH为4)进行清理。结果总结在图1中。
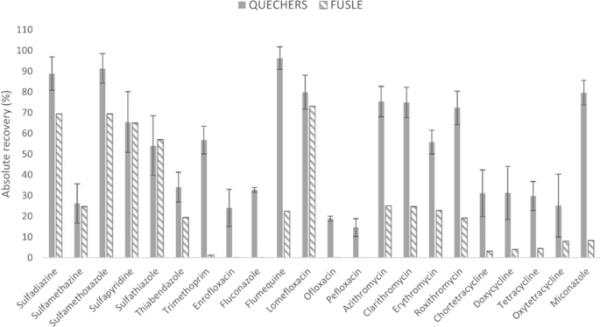
采用QuEChERS-SPE(快速、简便、廉价、高效、坚固、安全的固相萃取)或FUSLE-SPE(聚焦超声固液萃取-固相萃取)萃取(danoflo沙星和霉酚酸无数据)后,每种目标分析物的绝对回收率(n = 4)
QuEChERS方法能够从土壤中提取几乎所有的抗菌剂:在22种被评估的分析物中,有20种堆肥样品的绝对回收率在24%到91%之间(在这个优化试验中,实验室中没有danoflo沙星和霉酚酸,但它们后来被纳入验证)。氧氟沙星和培氟沙星的绝对回收率较低,分别为19%和15%。所有目标化合物的RSD值均低于15%,重复性良好。采用FUSLE萃取法,22种分析物中只有10种的回收率在22 ~ 73%范围内。与基于quechers的提取法相比,sa的提取无统计学差异(t = 0.6 < tcrit = 2.3),但TCs、MCs、噻苯达唑、甲氧苄啶和咪康唑的回收率明显降低,FQs的提取也没有提高。此外,使用FUSLE(为避免尺度问题未包括在图1中)获得的RSD值高于57%,表明其在精度方面的不足。基于quechers的提取方法被认为是最优的,并被用于进一步的实验。
QuEChERS中样品pH值的评价
在不同的pH值(即pH 2.5、pH 4和pH 7.5)下调整样品,并测定QuEChERS提取的绝对回收率(见图2)。结果表明,在研究的pH值中,pH 7.5的回收率最低。虽然在pH 4条件下提取某些sa (pH 4为96-117%,pH 2.5为63-114%)和氟康唑(pH 4为103%,pH 2.5为75%)的提取率略高,但在这些提取条件下不能提取TCs和FQs。因此,将pH值设定为QuEChERS提取的最佳值,24种分析物中只有3种(达诺沙星、氧氟沙星和培氟沙星)的绝对回收率低于20%。
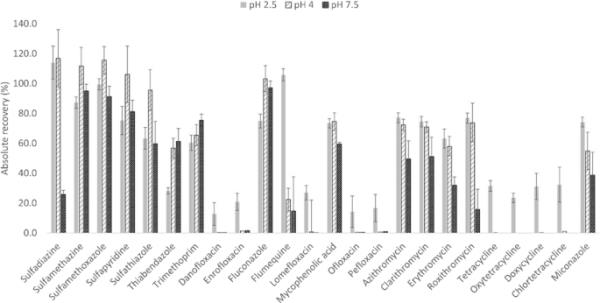
目标分析物在不同pH值下的QuEChERS(快速、简便、廉价、高效、坚固、安全)的绝对回收率(n = 3)(包括danoflo沙星和霉酚酸的数据)
SPE净化步骤的优化
使用加钉土(QuEChERS萃取的堆肥样品,pH值为2.5)(见“QuEChERS”部分),一式三次评估SPE吸附剂的量、萃取物的装载量(70ml, 200mg装瓶或140ml, 500mg装瓶)和pH值(pH值为4或7.5)。
根据FQs的酸碱性质选择研究pH值(表S1)。pH值高于4时,官能团可以同时带正电荷和负电荷电离。离子补偿导致电中性化合物在Oasis HLB SPE筒中表现出更好的吸收[18]。根据观察结果(见图3),不同的提取回收率取决于提取物的pH。在pH 4下进行的实验显示,无论加载的提取物体积大小,tc和MCs的提取回收率都较高,特别是当加载大提取物体积(140 mL)时(t = 7.4 > tcrit = 2.5, t = 9.1 > tcrit = 2.5)。在pH = 4和不同上样量/药筒质量(即200 mg药筒上样量为70 mL, 500 mg药筒上样量为140 mL)下进行的分析没有统计学差异(t = 0.1 < tcrit = 2.0)。基于之前的结果,并考虑到在140 mL体积的情况下,为了保证在SPE中有效上样(上样液中有机溶剂< 5% (v/v)),需要更高的提取物稀释度(因此需要更长的上样时间),因此将70 mL设置为最佳上样体积。
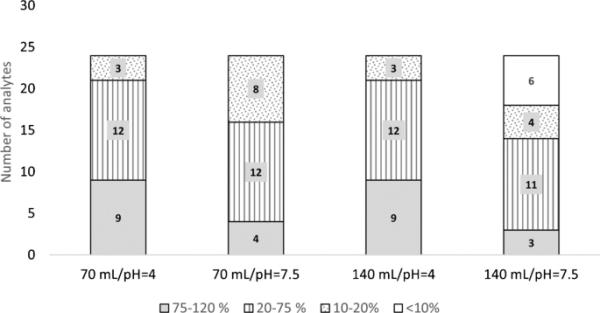
土壤中回收的分析物的绝对回收率和数量:清理步骤中每个评估条件下的堆肥样品:样品pH值(pH 4和pH 7)和样品装载量(70 mL和140 mL)
建立了土壤的最佳SPE净化条件:堆肥样品用于粪便提取物的净化,但使用500 mg-Oasis hlb -筒;因此,研究了提取液的装载量。当将20 mL或40 mL粪便提取物加载到SPE筒中时,在色谱峰对称性,保留时间(见图4)以及提取效率(t = 0.1 < tcrit = 2.0)方面均未观察到统计学差异。因此,为了获得较高的预富集系数,确定提取液的最佳上样量为40 mL。
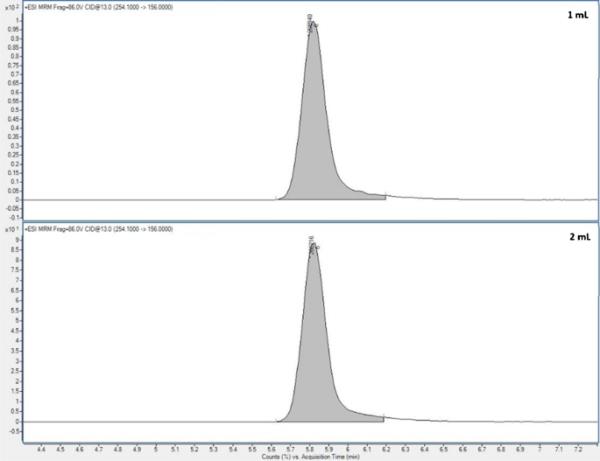
粪便样品中磺胺甲恶唑(作为目标分析物的代表)的色谱图,装载量为500 mg-SPE盒(20 mL或40 mL)
功绩数字
仪器参数
用ACN:草酸(50:50,v:v)制备的12点外标曲线(0.25-100 μg·kg−1)对目标物进行定量。在0.997 ~ 0.999的范围内,观察到每个目标分析物具有良好的线性关系。此外,通过在同一天和不同日期分别注入0.25 ~ 25 μg·kg−1范围内的外标液,对UHPLC-MS/MS系统测量结果的仪器重复性和中间重复性进行了评估。在所有浓度水平下,所有分析物均具有足够的重复性和中间重复性(RSD %值分别低于25%和22%)。此外,对于每种目标分析物,仪器定量限(LOQINS)计算为相对标准偏差(RSD %)和相对理论值的系统误差低于30%的最低外部校准点。所有化合物的LOQINS均小于0.93 μg·kg−1(表S3)。
定量程序限(LOQ)箴)
LOQPRO由程序空白的平均信号之和加上10倍的标准偏差计算得到。对于该结果,应用外部校准和绝对回收率,获得样品中每种分析物的最终LOQPRO值。对于土壤:堆肥样品(见表1),LOQPRO范围为0.45 ~ 7.50 μg·kg−1。由于LOQPRO值为9.89 μg·kg−1,培氟沙星是唯一不能在最低水平下验证的抗菌药物。与Meng等[27]发表的结果相比(见表S4),本研究对磺胺嘧啶、磺胺噻唑、磺胺吡啶和克拉霉素的LOQPRO值更好,而对红霉素和罗红霉素的LOQPRO值更好。在Salvia等人[45]发表的研究中,报道了较低的LOQPRO值(0.02-2.14 ng·g−1),但在该研究中,LOQPRO的估计方式不同(即,分析物浓度产生的峰值信号是色谱背景噪声的十倍)。
粪肥样品(见表2)除氧氟沙星(5.53 μg·kg - 1)和培氟沙星(15.75 μg·kg - 1)无法定量外,其余均在3.21 μg·kg - 1以下,土壤堆肥样品亦如此。Hou等人[25]对TCs和FQs也给出了类似的数值(见表S4),尽管他们将LOQPRO定义为与信噪比(S/N)为10相对应的最低浓度水平。另一项科学工作将LOQPRO定义为等于用于确定合理检出限(LOD)的一系列重复结果的标准偏差的十倍,报告了肉鸡粪便中更高的LOQPRO值(3.0-14.0 μg·kg−1)[46]。
检测时的矩阵效应
基质效应是影响方法准确性的一个重要因素,特别是当ESI用于分析复杂基质时,因为其他基质成分可能作为干扰改变目标分析物的电离。在本工作中,根据式1计算矩阵效应,其中B为参考标准样品中分析物的峰面积,a为与标准溶液浓度相同的色谱分析前加标样品中分析物的色谱峰面积。
(1)负值表示目标分析物的色谱信号丢失(离子抑制),这是MCs和sa的情况,而正值反映离子增强,如土壤堆肥样品中其他抗菌家族的情况(见图5)。总的来说,在这项工作中,检测时观察到的矩阵效应并不显著,所有的值都低于22%。不管分析的是何种复杂基质,观察到的基质效应较低的原因可能是清理步骤的效率。Salvia等人也进行了SPE清理[45],使用强阴离子交换筒(SAX)和聚合物筒(Strata-X);然而,选择吸附剂纯化步骤似乎不是最佳选择,因为sa的离子抑制率超过- 30%,而罗红霉素在50 μg·kg - 1验证水平上的离子抑制率提高了242%。与Meng等[27]的结果相比,本工作检索到红霉素、罗红霉素和磺胺吡啶的基质效应明显降低。在Meng等人的研究中,采用分散式固相萃取(dSPE)进行清理,使用较少的吸附剂(25 mg PSA + 10 g C18 vs 200 mg Oasis HLB)可以减少共洗脱基质干扰的保留,从而在检测中产生更大的基质效应。然而,与使用dSPE作为清理策略的其他研究相比,本研究中观察到一些sa的基质效应相似[23,34]。
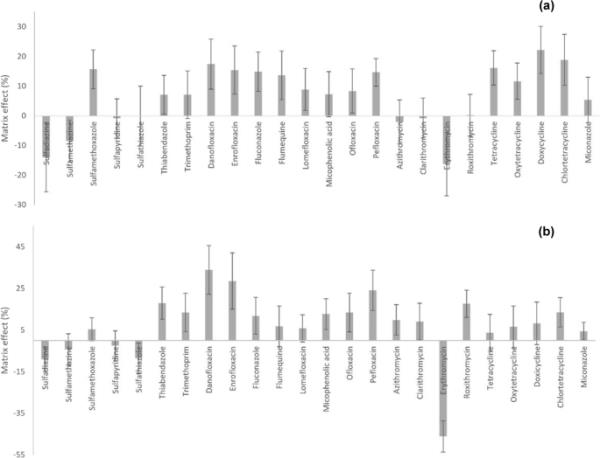
土壤中每种目标分析物检测时的基质效应:堆肥(a)和粪肥样品(b)
在动物粪便中,除红霉素外,几乎所有分析物均呈离子增强,其ME %为负(- 46%)最为显著。无论如何,对于其余的目标分析物,ME %保持在30%以下。即使Hou等人使用SAX滤芯(3ml / 200mg)和Oasis HLB滤芯(6ml / 500mg)进行粪便样品纯化,与本研究结果相比,所研究的所有FQs、sa、tc、mc和甲氧苄啶的基质效应都更高[25]。
真实和精确
在10、25和50 μg·kg−1 3个浓度水平下,对堆肥和粪肥样品中的QuEChERS提取方法进行了验证。采用外标曲线计算绝对回收率。为了确定方法的准确性,使用两种不同的方法计算表观回收率:(i)使用氘化类似物作为替代物,在程序开始时加标(目标分析物与相应替代化合物的绝对回收率之间的比率)和(ii)使用六点基质匹配校准(1 - 75 μg·kg−1)。在使用最后一种方法获得浓度之前,确保校准曲线的充分性(r2在0.975 ~ 0.999之间),重复性(以RSD表示,小于20%)。
在土壤堆肥样品中,在10 μg·kg−1浓度水平下,绝对回收率(n = 3)在21 ~ 89%之间,在25 μg·kg−1浓度水平下在20 ~ 79%之间,在50 μg·kg−1浓度水平下在19 ~ 79%之间(见表1)。在3个验证水平下,某些FQs的回收率较低(10 ~ 20%)。这些值与Salvia等[45]测定的sa值相当,但该方法对红霉素的提取效率仍然更高。da Silva等人[21]在进行了基于le的提取后,报告了sa的回收率更高,而tc的回收率也相似。在低、中、高浓度条件下,所有目标化合物的表观加标回收率分别为72 ~ 132%、77 ~ 138%和79 ~ 130%。在最低加标浓度水平(即10 μg·kg−1)下,磺胺甲基嗪(58%)和罗红霉素(47%)抗菌药物除外,而丹氧氟沙星、氧氟沙星和培氟沙星这3种FQs抗菌药物在3个加标水平上的加标回收率为43% ~ 66%。尽管这些分析物超出了指南2021/808[42]所规定的范围,但根据标准SANTE/11813/2017,在证明其一致性(RSD < 20%)的情况下,较低的回收率(30-70%)是可以接受的。除10 μg·kg−1的氯霉素和霉酚酸(分别为26%和23%)外,所有验证点的所有抗菌药物的精密度均低于20%(以RSD %表示),这意味着该方法在所研究浓度水平下的分析仍然具有可重复性和可靠性。
当采用基质匹配校准方法测定表观回收率时,本工作中包括的所有抗菌素在25 μg·kg - 1和50 μg·kg - 1水平下均满足法规(EU) 2021/808[42]中规定的真实度要求(80-120%)。在最低验证浓度水平(10 μg·kg−1)下,除霉酚酸(32%)外,加样回收率上限为137%,其余rsd均< 20%。
与文献(表S4)比较,在50 μg·kg−1加标条件下,土壤堆肥样品的表观回收率与Meng等[27]报道的红霉素、罗红霉素、克拉红霉素、磺胺甲基嗪和磺胺甲恶唑的表观回收率相似,但本文方法的重复性更好。此外,本工作还检索到磺胺嘧啶和磺胺噻唑的较好结果。此外,与Martínez-Piernas等人[23]开发的方法相比,该工作还提供了更高的sa (46-63% vs 105-116%)和flumequine (34% vs 93%)分析的准确性,但甲氧苄啶和MCs的回收率相似。在Lee等人[34]开发的QuEChERS方法中,与我们的研究报告相比,测定了较低的sa回收率(65-73%)。
对于粪便样品(表2),总体而言,除了甲氧苄啶(11-17%)和达诺沙星(14-23%)外,在三个评估的验证水平上,所有分析物的绝对回收率均为21-95% (n = 3)。除3个FQs和甲氧苄啶的RSD为最低验证水平(RSD 20-29%)外,RSD %均低于20%,表明精密度良好。总的来说,当采用替代校正时,几乎所有抗菌素都达到了真实度标准[43],回收率在80-120%范围内。只有磺胺噻唑、甲氧苄啶和达诺沙星的回收率为44 ~ 67%,表明需要进行更好的替代选择,以满足该方法分析这些化合物的准确度要求。Berendsen等人报道了一些TCs、FQs和红霉素的类似恢复值[47]。与Hou等人所做的工作相比,本研究在低验证水平和高验证水平上对TCs、FQs、sa和MCs的量化的准确性更高[25];然而,他们在替代校正后获得了更好的甲氧苄啶回收率值(在10 μg·kg - 1验证水平下为73%对49%,在50 μg·kg - 1验证水平下为72%对50%)。Ho等[46]在200 μg·kg−1验证水平下也获得了较好的甲氧苄啶提取效果;尽管如此,该方法仍然被证明是更准确的磺胺嘧啶和强力霉素的定量。然而,当在本工作中使用基质匹配校准策略时,获得了可接受的表观回收率,特别是对于那些不能通过使用替代物校正的化合物(即磺胺噻唑、甲氧苄啶和达诺沙星的回收率在72 - 121%之间)。
下载原文档:https://link.springer.com/content/pdf/10.1007/s00216-023-04905-2.pdf

