摘要
背景
实验研究表明,暴露可能通过表观遗传变化,特别是通过男性生殖细胞传播,影响几代人的呼吸系统健康。然而,对人类的研究是有限的。我们的目标是确定与父亲孕前吸烟相关的后代表观遗传标记。
方法
我们在RHINESSA队列(7-50岁)中对父亲孕前吸烟(n = 875名后代)和父亲青春期开始吸烟< 15年(n = 304名)进行了全表观基因组关联研究(EWAS),使用Infinium MethylationEPIC头芯片阵列,调整后代年龄、自己吸烟和母亲吸烟。对母亲和子代个人吸烟的EWAS进行比较。在没有个人吸烟和母亲没有吸烟暴露的后代亚群中检查父亲吸烟相关的dmcpg。
结果
在PRR5和CENPP中,父亲从孕前开始吸烟与后代两个胞嘧啶-磷酸-鸟嘌呤位点(CpGs)的血液DNA甲基化相关(错误发现率(FDR) < 0.05)。父亲青春期开始吸烟与14个基因(TLR9、DNTT、FAM53B、NCAPG2、PSTPIP2、MBIP、C2orf39、NTRK2、DNAJC14、CDO1、PRAP1、TPCN1、IRS1和CSF1R)的19个CpGs相关(FDR < 0.05)。这些差异甲基化位点被高度甲基化,并与能够基因沉默的启动子区域相关。其中一些位点与后代结局相关,包括多次哮喘(NTRK2)、多次喘息(DNAJC14、TPCN1)、体重(FAM53B、NTRK2)和BMI (FAM53B、NTRK2) (p < 0.05)。通路分析显示,基因表达调控、炎症和先天免疫应答等基因本体通路富集。父亲吸烟相关位点与个人和母亲吸烟的EWAS中鉴定的dmcpg没有重叠(FDR < 0.05),在不吸烟和母亲不吸烟的后代分析中,所有位点仍然显著(p < 0.05)。
结论
父亲孕前吸烟,特别是在青春期吸烟,与后代DNA甲基化有关,这为表观遗传机制可能是流行病学观察的基础提供了证据,即青春期父亲吸烟会增加后代哮喘、肺功能低下和肥胖的风险。
介绍
越来越多的人一致认为,即使在他们的后代怀孕之前,父母接触表观基因组的扰动可能解释了全基因组关联研究(GWAS)未捕获的健康和疾病遗传力的一些变化。未来父母的青春期,尤其是父亲,可能是生理变化和表观遗传重编程事件的关键窗口期,这可能会增加个体对环境暴露的易感性,并体现在发育中的配子中[1,2]。动物和人类研究表明,产前和个人吸烟暴露与影响精子数量和质量的表观遗传修饰有关[3]。现在,人们越来越关注与父母孕前期相关的表观遗传修饰(如DNA甲基化(DNAm))如何影响下一代的健康[4]。
虽然吸烟率普遍下降,但在欧洲国家,15岁以前开始吸烟的人数正在增加[5,6]。流行病学研究表明,父亲在青少年时期吸烟可能是导致后代呼吸系统健康状况较差的一个原因。父亲在15岁前开始吸烟和怀孕前吸烟持续时间与后代哮喘发病率和肺功能低下有关[7,8,9]。父亲孕前吸烟也与儿子较高的体脂量有关[10,11,12,13]。
表观基因组关联研究(EWAS)已经发现了广泛的甲基化生物标志物与个人吸烟相关[14],与当前和以前吸烟者的全因死亡率以及母亲在怀孕期间吸烟相关[15,16,17]。虽然以前的研究已经确定了后代血液中的DNA甲基化信号[16]和脐带血[17]与父亲吸烟有关,但他们并没有专门调查暴露的时间,部分原因是很少有来自父亲的详细吸烟信息[18]。与父亲孕前吸烟相关的甲基化标记可能在阐明对后代表观基因组的长期影响方面发挥重要作用,具有制定有效干预方案和改善公共卫生的潜力。
本研究旨在调查在后代血液中测量的DNA甲基化是否与父亲在怀孕前开始吸烟有关,特别是与父亲在青春期前(15岁之前)开始吸烟有关。我们假设涉及DNA甲基化的表观遗传变化可以解释流行病学研究中观察到的父亲吸烟孕前与后代健康之间关联的分子机制。此外,我们假设父亲在青春期早期吸烟,比在更晚的年龄开始吸烟,可能对后代表观基因组有更显著的影响。在一个两代队列中,我们试图确定后代血液(7-50岁)中DNA甲基化变化与以下因素的关系:(1)父亲在孕前开始吸烟与从未或后来开始吸烟相比;(2)父亲在15岁之前开始吸烟与从不吸烟相比。最后,鉴于流行病学研究报告了后代的性别特异性结果[10,19],我们想探讨父亲孕前吸烟与后代DNA甲基化之间的关联模式是否在儿子和女儿中有所不同。
方法
研究设计与数据
我们使用了参与RHINESSA研究(www.rhinessa.net)的7-50岁后代的数据和样本。父母数据,包括吸烟习惯的详细信息,从基于人群的欧洲共同体呼吸健康调查(ECRHS, www.ecrhs.org)和/或北欧呼吸健康研究(RHINE, www.rhine.nu)研究中检索。该分析包括875对具有完整信息的后代-父母对,来自六个研究中心,为后代提供可用的外周血(丹麦奥胡斯;阿尔瓦塞特省/瓦,西班牙;挪威卑尔根;澳大利亚墨尔本;爱沙尼亚塔尔图)。所有的参与者都是白种人。每个研究中心的医学研究委员会批准了这些研究,每个参与者都给予了书面同意。伦理批准参考编号列在www.rhinessa.net上。
在访谈/问卷中报告父亲的吸烟情况和开始/戒烟的年龄,并与子女的出生年份相关,定义类别:从不吸烟(n = 547),任何孕前吸烟(n = 328),孕前吸烟< 15年(青春期吸烟)(n = 64)(以平均声带破裂年龄14.5岁,第一次夜间遗精14.8岁为分界点)。个人吸烟分为现在吸烟、曾经吸烟和从不吸烟。母亲吸烟的定义是通过后代报告母亲在童年/怀孕期间的吸烟情况。
甲基化分析和处理
采用简单的盐析程序,从外周血中提取1µg DNA,测量子代DNA[20]。在Oxford Genomics Centre (Oxford, UK)使用EZ 96-DNA甲基化试剂盒(zimo Research, Irvine, CA, USA)进行亚硫酸转化,并使用Illumina Infinium MethylationEPIC珠片阵列(Illumina, Inc.)进行甲基化评估。CA, USA),样品随机分布在微阵列上,以控制批次效应。
数据分析使用Statistical Computing Program R,版本3.6.1[21]。使用minfi[22]和Mefil[23]对甲基化强度文件进行处理并评估其质量。使用密度和多维标度图、甲基化与非甲基化比率图、性别不匹配和性别异常值、对照探针和亚硫酸转化效率来评估异常值的甲基化分布。使用BMIQ进行归一化[24],调整2型设计探针和1型探针的样本内β值。去除冠军在p值为1 × 10-10时检测到的技术变异。将CHAMP包中的SVD函数[25]、SVA[25]中的ComBat应用于样品批和载玻片。
根据以下标准将探针排除在分析之外:探针检测p值高于0.01的一个或多个样本(n = 27206探针),探针与beadcount < 3至少5%的样品(n = 1451), non-cg探测器(n = 2580),探针与单核苷酸多态性中确定周et al。[26](n = 92403),与多个杂交探针的位置确定在Nordlund等。[27](n = 51)和探测器的X或Y染色体(n = 15776)和可交叉反应的调查在史诗数组(n = 2368)被Pidsley et al[28]。共使用724,292根探针进行下游分析。使用EpiDISH (Epigenetics Dissection of Intra-Sample Heterogeneity)估计细胞类型比例[29]。
统计分析
我们以DNA甲基化为结果,对孕前父亲吸烟(任何孕前吸烟和青春期前吸烟)进行了两次EWAS。为了鉴定差异甲基化的胞嘧啶-磷酸-鸟嘌呤(CpG)位点(dmCPG),在错误发现率(FDR)的显著性水平[31]校正p值< 0.05后,利用limma[30]对β值应用鲁棒多元线性回归模型,对后代的性别、年龄、个人和母亲的吸烟情况以及细胞类型比例(B细胞、自然杀伤细胞、CD4 T细胞、CD8 T细胞、单核细胞、中性粒细胞)进行校正。由于估计非常低,并避免潜在的多重共线性,嗜酸性粒细胞未包括在内。在另外的分析中,父亲孕前吸烟和后代DNA甲基化之间的关系也根据后代的性别进行了分层。
Manhattan plot使用qqman[32]生成,circos plot使用CMplot R软件包生成[33]。系统偏差导致的通货膨胀使用BACON进行调整[34]。使用dmrff[35]和DMRCate[36]检测差异甲基化区域。使用eFORGE TF进行转录因子结合位点预测[37]。基因与疾病的关联采用开放靶法进行鉴定[38]。将鉴定出的dmcpg与EWAS图谱进行比较,以确定其与已知生物学性状的关联[39]。为了深入了解基因dmcpg的生物学意义,我们使用String[40]鉴定基因相互作用因子,并使用UniprotR[41]和gometh[42]进行富集。显著差异甲基化CpGs (dmcpg)的生物学解释在补充方法中详细介绍。
为了进一步研究鉴定的dmcpg是否与后代的呼吸结局和体重相关,我们在考虑后代性别的同时,对后代的DNA甲基化信号与后代自己报告的哮喘、喘息、体重和BMI进行了回归分析。
我们构建了另外两个关于后代个人和母亲吸烟的EWAS,以评估每个EWAS之间dmcpg的共享计数和重叠(FDR < 0.05),并允许与确定与父亲孕前和青春期吸烟相关的dmcpg进行比较。为了解决后代个人吸烟和母亲吸烟的潜在混淆问题,还在报告没有个人吸烟暴露的后代和没有母亲吸烟暴露的后代亚群中检查了检测到的dmcpg的关联。
我们的EWAS结果还与以下研究结果进行了比较:4个基于人群的队列中EPIC阵列DNA甲基化与个人吸烟相关的荟萃分析[43]、16个队列中使用450K阵列的个人吸烟-甲基化效应[14]以及妊娠与儿童表观遗传学联盟(PACE)对母亲孕期吸烟对后代脐血甲基化的荟萃分析[15]。
复制分析
在ALSPAC(雅芳父母和儿童纵向研究)队列中进行了复制,调整了预测的细胞计数比例、批量效应(平板)、孕妇在怀孕期间吸烟、自我报告自己吸烟、年龄和性别,使用15-17岁全血DNA甲基化数据。在补充方法中提供了对ALSPAC队列的描述。采用T检验比较rhessa的dmCpG位点FDR < 0.05和前100位CpG位点与ALSPAC的回归系数的相关性。签名检验用于检验关联方向。
敏感性分析
为了评估父亲吸烟相关的dmcpg是否可能被社会阶层的影响所混淆,我们将父亲的教育水平(社会经济背景的替代衡量标准)作为自变量,并将其与确定的dmcpg进行回归。在随后的分析中,后代年龄的影响也得到了更广泛的研究,通过将RHINESSA EWAS研究中已知的与年龄相关的CpG标记相关联,两个最高的CpG被确定为与父亲吸烟有关,以及与后代的年龄有关。
目录
摘要 介绍 方法 结果 讨论 结论 数据和材料的可用性 参考文献 致谢 作者信息 道德声明 补充信息 相关的内容 搜索 导航 #####结果
该分析包括875名RHINESSA参与者(表1A), 457名男性和418名女性,年龄在7至50岁之间。其中328人的父亲在怀孕前曾吸烟(父亲在子女出生前减去2年开始吸烟),其中64人在15岁之前开始吸烟;263人的母亲曾经吸烟,240人自己吸烟。还给出了304名子女的子样本的特征,这些子女的父亲要么在15岁之前开始吸烟,要么从不吸烟(在子女受孕之前或之后)(表1B)。
preco的全表观基因组关联分析除了爸爸抽烟
父亲孕前吸烟与后代DNA甲基化之间的全表观基因组关联鉴定出两个dmcpg(膨胀λ = 1.187);cg00870527映射到PRR5, cg08541349映射到CENPP(表2A和附加文件1:表E1)。相关dmcpg的全基因组分布如图1A所示。图2A显示了从不吸烟组和曾经吸烟组之间两个CpG位点甲基化β值的比较。在这两种情况下,“曾经吸烟”父亲的后代的甲基化值都明显较低;PRR5中的cg00870527 (p值= 0.0003)和CENPP中的cg08541349 (p值= 0.0000092)。
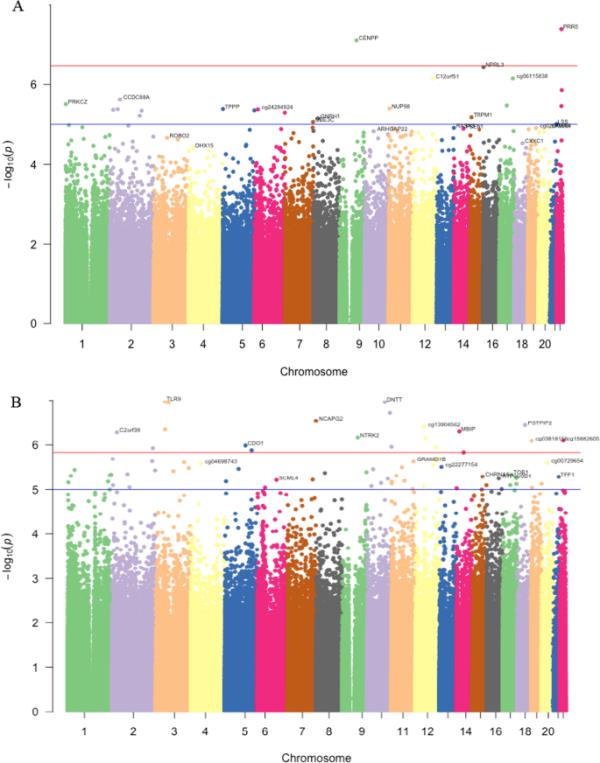
dmcpg全基因组分布的曼哈顿图。A:父亲是否在怀孕前吸烟B:父亲是否在15岁前开始吸烟。红线表示全基因组意义,蓝色为提示线。y轴表示每个dmCpG的p值的−log10(用点表示),表示关联强度。x轴表示横过常染色体的位置。每条染色体上的顶部dmcpg被注释到最近的基因上
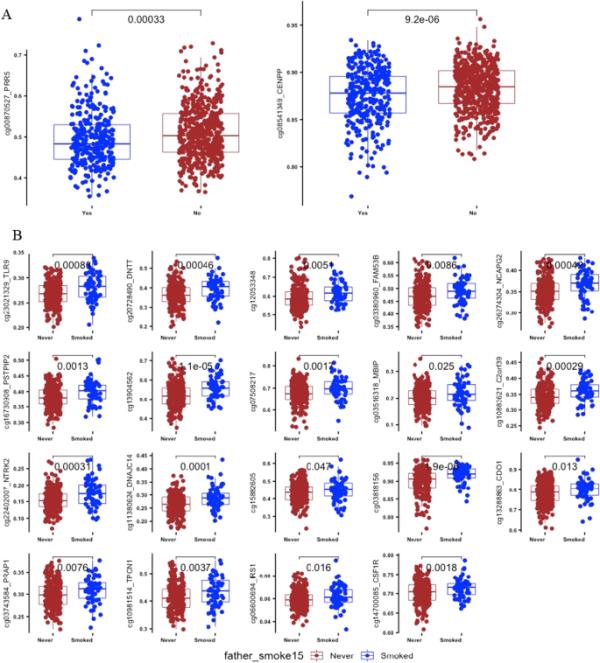
箱形图显示了EWAS中重要dmcpg位点的甲基化水平(β值)分布。A:父亲是否在怀孕前吸烟;B:父亲是否在15岁前开始吸烟。每个dmCpG的箱形图上方显示了从不吸烟暴露和吸烟暴露后代之间的比较p值
在性别分层分析中,在男性(n = 457)中,我们确定了4个dmcpg,分别定位于KCNJ1、GRAMD4、TRIM2和MYADML2。在女性(n = 418)中,有一个dmCpG映射到LEPROT1 (FDR < = 0.05)(附加文件1:表E2)。所有性别特异性dmcpg均低甲基化。
为了明确确定与父亲早发吸烟相关的特征,我们比较了父亲开始吸烟< 15年的后代(n = 64)与从不吸烟父亲的后代(n = 240)之间的甲基化差异。我们发现55个dmcpg在FDR < 0.05 (λ = 1.44)时具有全基因组意义。在使用BACON调整通货膨胀后,19个dmcpg在FDR < 0.05时显示出显著的相关性,λ = 1.29(表2B,图1B和附加文件1:表E3)。这些dmcpg被定位到14个已知基因和5个基因间区。这些基因包括TLR9、DNTT、FAM35B、NCAPG2、MBIP、C2orf39、NTRK2、DNAJC14、CDO1、PRAP1、TPCN1、IRS1、PSTPIP2和CF1R。暴露组的所有hit都出现了高甲基化。甲基化分布在从未和烟雾暴露的比较如图2B所示。
与父亲孕前吸烟相关的dmcpg主要位于公海基因组特征中,并在启动子区域富集(表2A)。与父亲青春期吸烟相关的dmcpg分布在公海基因组特征和CpG岛海岸(CpG岛上下< 2kb的侧翼海岸区域),并在CpG岛和基因体中富集(表2B)。
父亲吸烟相关dmcpg与后代表型之间的关系
部分鉴定的dmCpG位点与哮喘(cg22402007: NTRK2)、哮喘(cg11380624: DNAJC14, cg10981514: TPCN1)、体重(cg12053348, cg03380960: FAM53B, cg22402007: NTRK2[44])和BMI (cg03380960: FAM53B, cg12053348, cg22402007: NTRK2)相关,p < 0.05,见表E4(附加文件1)。
父亲的preco概念吸烟签名与人签名的比较Nal和妈妈在抽烟
我们发现33个dmcpg与个人吸烟相关,14个dmcpg与母亲吸烟相关(FDR < 0.05)(附加文件1:表E5和表E6)。
为了说明个人、母亲和父亲吸烟对后代甲基组的独特和共有的全基因组影响,我们进行了一个基因座对基因组的比较(图3)。虽然个人吸烟和母亲吸烟对5号染色体的影响存在相似性,但我们观察到父亲孕前吸烟在22号染色体上的明显特征,以及母亲吸烟在7号和15号染色体上的明显特征。
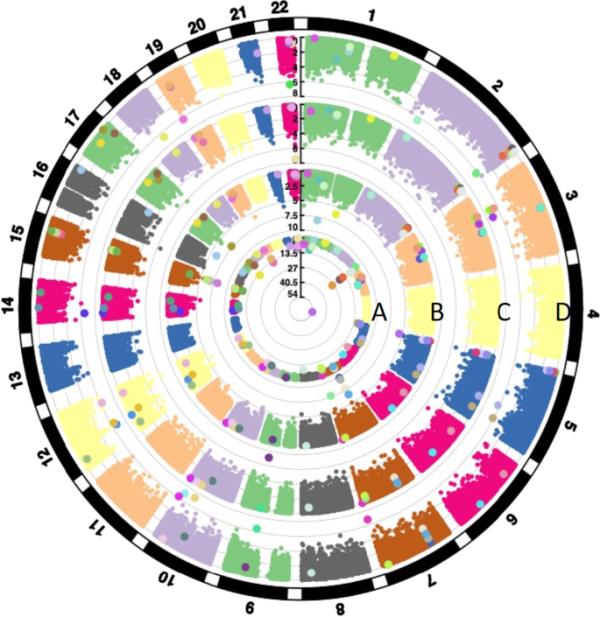
Circos图显示了与以下因素相关的dmcpg在常染色体上的全基因组分布:A个人吸烟(后代),B母亲吸烟,C父亲怀孕前吸烟,D父亲青春期吸烟(15岁前开始)。每个点代表一个CpG位点;径向线表示每个EWAS的−log10p值。放大后的点显示CpG位点在至少一个EWAS显著;每个放大的点颜色表示一个独特的CpG位点特异性位点
为了证实父亲吸烟相关的dmcpg不受后代自身或母亲吸烟的影响,我们对报告没有个人吸烟暴露和母亲没有吸烟暴露的后代亚群进行了敏感性分析。考虑到所有协变量(后代年龄、性别、研究中心和血细胞类型比例),在这些分析中,所有与父亲吸烟相关的dmcpg在p值< 0.05时仍然显著(附加文件1:表E7)。尽管样本量很小(n = 175),当我们将母亲在整个怀孕期间持续吸烟作为协变量考虑时,19个确定的dmcpg中有13个与父亲吸烟显著相关,p值< 0.05(附加文件1:表E7)。
将我们的EWAS结果与之前发表的关于母亲和个人吸烟的荟萃分析结果进行比较,我们发现与父亲青春期吸烟相关的19个dmcpg中有16个与母亲或个人吸烟无关[14,15,43](图4A, B)。在450k阵列上也存在9个已确定的CpG位点(附加文件1:表E8)。两个CpG位点(cg11380624 (DNAJC14), cg20728490 (DNTT))与Joehanes等人[43]的个人吸烟分析共享;两个位点(cg12053348(基因间),cg20728490 (DNTT))与Christiansen等人[14]共享。相比之下,我们的14个母亲吸烟相关的dmcpg中有10个,其中11个cpg也出现在450K阵列中,我们的25个个人吸烟相关的dmcpg,其中23个cpg出现在450K阵列中,也被报道在meta分析结果中[14,15,43](附加文件1:表E8)。
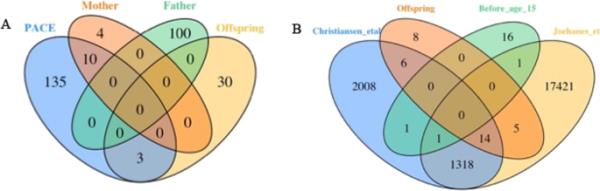
维恩图解显示ewa CpG点击率最高个人(后代)吸烟,母亲吸烟(罗斯福< 0.005),父亲的任何偏见吸烟(最高100 dmCpGs)和父亲的发育期的15岁之前开始吸烟(罗斯福< 0.05)RHINESSA队列中,共享与荟萃分析点击率最高速度的母亲吸烟(蓝色椭圆形)据Joubert et al . 2016和B个人吸烟签名据克里斯琴森et al . 2021(蓝色)和Joehanes et al . 2016(黄色)
相关性状的dmcpg富集
我们利用EWAS图谱中已发表的EWAS文献库,研究了与父亲孕前吸烟相关的显著dmcpg是否与其他特征重叠。父亲任何孕前吸烟的前23个dmCpG位点(p值≤9.86 × 10-06,明显低于以下位点)富集免疫球蛋白E (IgE)水平、肌肉肥大、母亲吸烟和出生体重等性状(图5A)。与父亲青春期吸烟相关的dmcpg (FDR < 0.05)在自身免疫性疾病、特应性、吸烟和青春期等特征上富集(图5B)。在母体和个人吸烟暴露的EWAS中检测到的与dmcpg相关的丰富性状在附加文件1中提供:图1A和1B进行比较。
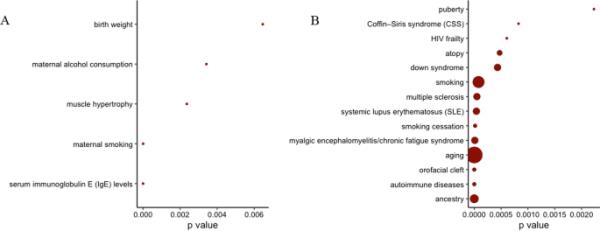
在EWAS中,与CpG位点相关的特征根据A父亲的任何孕前吸烟,B父亲的青春期吸烟开始于15岁之前被确定为差异甲基化
dmcpg在父亲青春期吸烟(开始吸烟< 15年)中的作用
鉴于父亲在青春期吸烟对后代DNA甲基化的影响比任何父亲吸烟的影响都要大,因此我们进一步探索了这些发现的生物学相关性。
反式转录因子富集
我们检测了eFORGE TF在CD4+细胞中转录因子的富集,以确定与父亲青春期吸烟相关的19个显著dmcpg (FDR < 0.05)的调节作用。我们发现27个转录因子结合位点与我们EWAS研究中发现的7个dmcpg重叠(q值< 0.05)(附加文件1:表E9)。
EWAS地图集查询
在我们的分析中发现的与父亲青春期吸烟相关的19个dmcpg中,有11个存在于EWAS图谱中,并且与EWAS图谱中多种组织中的基因表达相关(图6A),并且与启动子重叠(图6B) (FDR < 0.05)。这些与其他9个特征显著相关,包括特应性和分数呼出型一氧化氮(cg23021329)、吸烟(cg20728490;cg16730908)、BMI (cg03516318)、急性淋巴细胞白血病(cg2240207)、癌症(cg11380624)和克罗恩病(cg10981514)(附加文件1:表E10)。
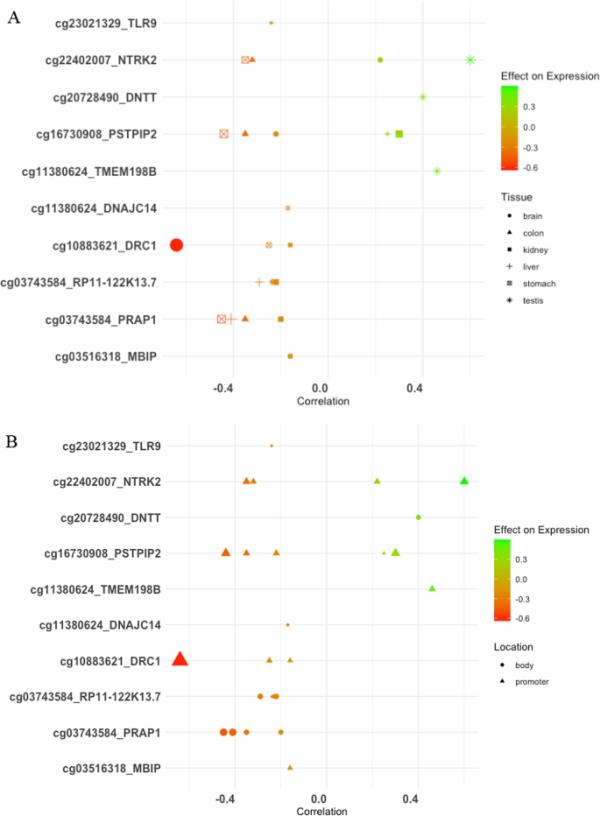
甲基化对不同组织类型CpG位点基因表达调控的影响(FDR < 0.05)。[2021年6月20日获取]。点的大小表示−log10 p值,色阶表示CpG位点与表达的相关性;从红色到绿色表示表情增加。A形表示组织类型;图B表示基因组特征位置
差异甲基化区(DMR)分析
使用dmrate或dmrff时,dmr与父亲的任何孕前吸烟均无显著相关。父亲青春期吸烟有暗含性的hit,如DNTT在FDR = 0.084。所有dmr列在附加文件1:表E11中。
通路富集
为了进一步了解dmCpGs的功能作用,我们使用了14个与父亲青春期吸烟相关的dmCpGs基因,从String数据库中生成了一个蛋白质-蛋白质相互作用网络。前20个蛋白质相互作用因子以高置信度得分0.7从蛋白质相互作用数据源中纳入,包括实验验证的蛋白质物理复合物,策划数据库和共表达。该网络表明免疫应答相关基因TLR9、CSF1R、NTRK2、PTPN11和IL34连接良好(图7A) (p值< 1.0 × 10−16)。分子功能富集分析显示基因表达、炎症反应、先天免疫和细胞因子结合富集(图7B)。我们还使用gometh评估了GO术语的富集程度。最显著富集的生物过程术语(FDR < 0.05)包括:参与渗透感觉信号通路的MAPK活性失活(GO:0000173),白细胞介素-6产生的负调控(GO:0032715),肥大细胞趋化性调控(GO:0060753),中性粒细胞迁移调控(GO:1902622)和胰岛素加工(GO:0030070)(附加文件1:表E12)。
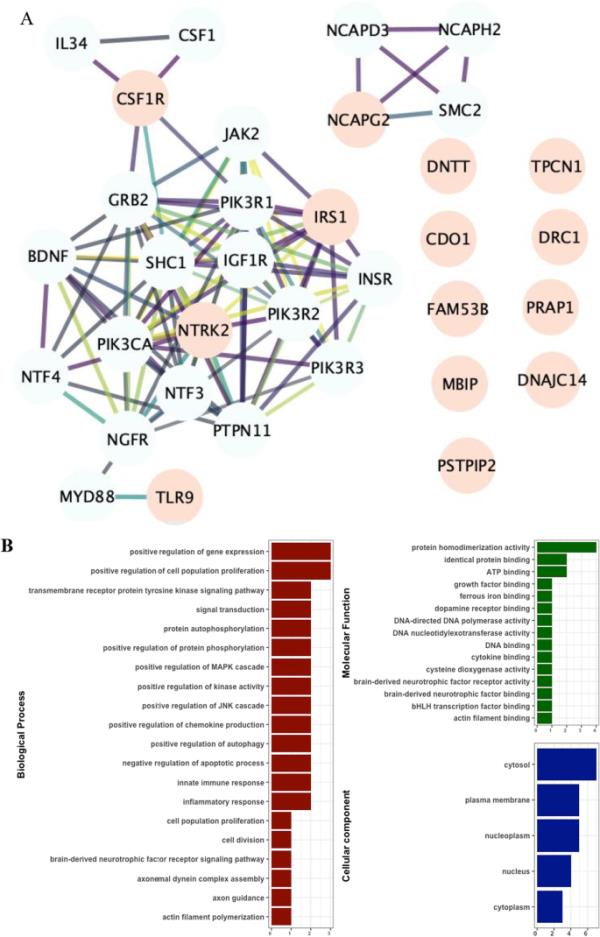
dmcpg与父亲青春期吸烟的相互作用。置信分数为0.7的String网络和20个顶级交互器(淡红色节点表示dmcpg,浅绿色节点表示顶级交互器)。相互作用的实验证据从0.0(弱)到1.0(强),使用颜色梯度黄色(0.06)到深紫色(1.0)。B从UniprotKb中富集了前15个生物过程、10个分子功能和5个细胞成分的功能
DNA甲基化特征的复制与父亲的preco有关nception吸烟
ALSPAC的重复队列包括542名参与者(女性= 280,男性= 262),其中86名参与者的父亲在15岁之前开始吸烟,456名参与者的父亲从未吸烟。在两个队列中,与父亲15岁前吸烟显著相关的dmCpG位点没有重叠(FDR < 0.05)。然而,在RHINESSA中鉴定的与父亲青春期吸烟相关的19个显著dmcpg中,有11个在ALSPAC中具有相同方向的象征性复制(p < 0.05)。研究间效应相关R = 0.49。经二项符号检验,p < 0.05显著相关。将比较范围扩大到RHINESSA中排名前100位的dmcpg,各研究间的效应相关性,R = 0.54, p值= 3.04 × 10-05。
敏感性分析
父亲的受教育水平与父亲孕前吸烟相关的最高dmcpg之间没有关联。父亲吸烟dmcpg与子代年龄相关性较弱(最大R = 0.2|,其中9 CpGs R = 0)。相反,正如预期的那样,与年龄相关的CpG标记物与年龄有很强的相关性(R > =|0.6|)(附加文件1:图2A, B)。研究能力见附加文件1:表E13。
下载原文档:https://link.springer.com/content/pdf/10.1186/s13148-023-01540-7.pdf

