摘要
万古霉素耐药肠球菌(VRE)的流行率不断上升,在欧洲各地的医院环境中是一个令人担忧的问题,没有明显的地理模式。在本综述中,我们比较了1991年至2022年间荷兰和德国医院中耐万古霉素肠球菌的流行病学。我们检索PubMed并汇总了两国的国家抗生素耐药性监测数据。我们纳入了46项研究,并总结了来自荷兰NethMap、德国国家抗菌素耐药性监测数据库和ear - net数据的国家监测数据。总共在荷兰的医院进行了12项研究,在德国的医院进行了32项研究,在跨境环境中进行了另外两项研究。两国之间最显著的差异是,德国的研究显示医院VRE患病率呈上升趋势,而荷兰的研究未观察到这种趋势。此外,在荷兰和德国的医院中,已经发现VREfm的分子流行病学多年来已经从vanA的优势转向了vanB。根据国家监测报告,在荷兰医院中,屎肠球菌临床分离株万古霉素耐药性波动在1%以下,而在德国医院中呈上升趋势(超过20%),这得到了个别研究的支持。本综述表明,VRE在德国医院比在荷兰医院更常见,并通过比较荷兰和德国在医疗保健系统、感染预防控制(IPC)指南和抗生素使用方面的差异,讨论了这两个邻国VRE发生率差异的潜在因素。
背景
肠球菌是世界上最常见的医院病原菌之一[1]。自20世纪70年代以来,多药耐药肠球菌在医疗保健中的传播(大多数归因于屎肠球菌)及其对医院环境的适应一直受到关注[1,2]。
肠球菌除了对头孢菌素、甲氧苄啶-磺胺甲恶唑和lincosamides等多种抗生素具有内在耐药性外,还可通过散发的染色体突变或外源基因交换获得耐药性[3]。肠球菌对氨基糖苷的高水平耐药以及对氨苄西林和糖肽的耐药是众所周知的获得性抗生素耐药的例子[3,4]。1986年法国报告了首例耐万古霉素肠球菌(VRE)病例;从那时起,它已成为全球医院感染的主要原因[5,6,7]。万古霉素耐药被认为是由于基因簇的获得改变了肽聚糖前体的性质;到目前为止,已经鉴定出9个不同的基因簇[8]:vanA, vanB, vanC, vanD, vanE, vanG, vanL, vanM, vanN。然而,在欧洲和世界范围内,vanA和vanB是人类VRE定植和感染的主要循环基因簇[5,9]。
鉴于VRE对医院环境中的一线抗生素具有耐药性,因此治疗选择有限,如利奈唑胺、替加环素和达托霉素[10]。然而,据报道,对这些最后手段的抗生素的耐药性日益增加[10,11,12,13,14]。因此,预防VRE感染对于避免治疗挑战至关重要[15]。
在过去的二十年中,研究提供了关于医院VRE感染负担的信息[5,16,17,18,19,20]。与万古霉素敏感肠球菌(VSE)感染相比,VRE感染具有更高的发病率、护理费用、更长的住院时间和死亡率[19,21,22]。不出所料,世界卫生组织(WHO)在2017年将VRE列为全球重要耐药菌名单中的高优先级病原体[23]。来自欧洲抗菌素耐药性监测网络(ear - net)的数据表明,2015年至2019年,欧洲VRE的流行率翻了一番,这证明了世卫组织的决定是正确的[24]。根据该报告,由于耐万古霉素E. faecium (VREfm)的流行增加,整个欧洲的万古霉素耐药性有所增加[24]。有趣的是,根据ear - net的数据,两个邻国,德国和荷兰,在所有入侵性粪肠分离株中VREfm的比例处于两端(荷兰< 1%,德国22.3%)。造成这种差异的根本原因尚不完全清楚[24]。尽管德国和荷兰有许多共同的历史、文化和社会价值观,但它们在医疗保健方面的许多方面存在差异。这些差异包括医疗结构、抗生素处方习惯以及地方和国家感染预防和控制(IPC)多药耐药微生物(MDRO)指南[25,26,27]。所有这些因素加在一起可能是导致这两个邻国VRE率差异的原因[25,27,28,29]。
尽管有证据表明荷兰和德国的VRE患病率存在差异,但迄今为止还没有全国性的比较研究详细说明这一情况。因此,本综述旨在根据文献和国家及欧洲监测数据,通过介绍德国和荷兰医院临床分离株的爆发、VRE定植流行率和VRE比例,来描述耐万古霉素肠球菌的流行病学。
方法
我们使用PubMed进行了一项范围综述,检索了荷兰和德国医院中提供VRE定植和感染流行率、发病率、监测和暴发数据的英语、荷兰语和德语出版物。按照PRISMA-ScR的建议进行评估[30]。我们执行了同行评审的搜索策略,于2022年12月30日执行。搜索词(附加文件1)由格罗宁根大学的研究图书管理员进行外部审查。作者(CC和MSB)使用同行评审搜索策略独立搜索和提取数据,以避免遗漏任何相关研究。这一策略没有遇到任何不一致之处。该数据集可在附加文件2中获得,感兴趣的人可以联系通讯作者进行进一步查询。
根据定义的流程图(图1)评估和纳入出版物的相关性。首先,纳入基于标题和摘要阅读。然后以全文访问选定的文章,以确定资格并提取数据。对合格出版物的参考书目进行了筛选,以增加文章。科学出版物必须符合以下所有纳入标准:报告的数据必须包括VRE分离株和/或病例的数量,研究必须在医院进行。从选定的出版物中提取以下数据:第一作者姓名、原产国、开展研究的省份、开展研究的时间框架、研究方法(疫情报告、监测报告、患病率/发病率研究)、医院类型、病房/ICU类型、研究涉及的病例/样本数量、VRE的数量和患病率、发病率或比例,以及抗性基因的存在(如有)。
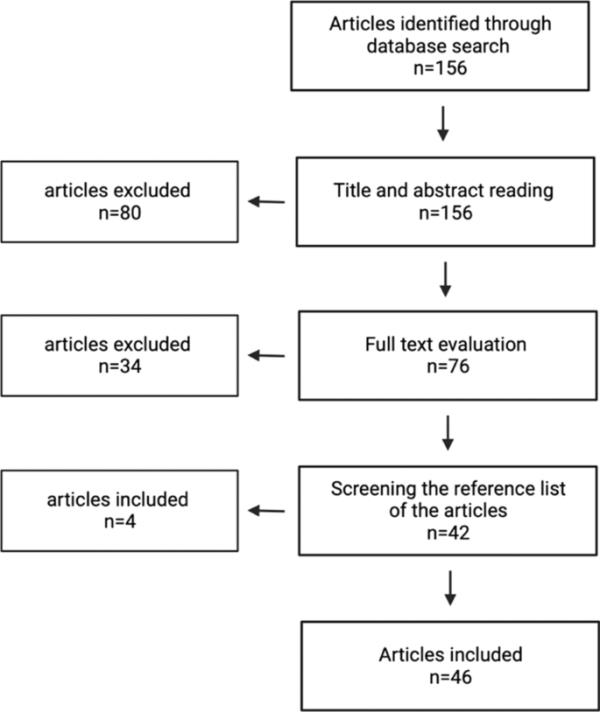
总结文献检索和选择过程
此外,通过从荷兰的NethMap和德国罗伯特·科赫研究所(RKI)建立的国家抗微生物药物耐药性监测(ARS)数据库中提取信息,以及从ear - net数据中提取两国的信息,对两国的国家监测数据进行了审查[31,32,33]。
结果
研究内容及特点
最初的搜索产生了156篇可能相关的出版物,其中80篇根据标题和摘要阅读被排除(图1)。另外32篇在全文评估后被排除。筛选了符合条件的研究的参考文献,并纳入了另外4项研究。最终,纳入了46份出版物(图1、2)。在选定的出版物中,12份在荷兰进行,32份在德国进行。另外两项研究是跨境研究,包括来自两国的数据。总共有一项生态研究、一项前后研究、一项纵向研究、四项队列研究、14项疫情报告和25项横断面研究。
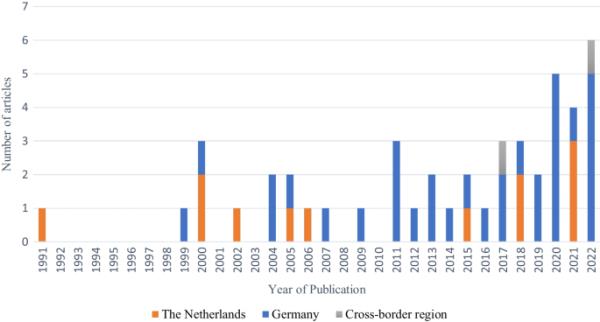
收录文章的出版日期
万古霉素耐药引起的爆发大肠都有效 (VREfm)
在荷兰进行的12项研究中,有8项是疫情报告(表1)[34、35、36、37、38、39、40、41]。在32份德国出版物中,有6份是疫情报告(表2)[42,43,44,45,46,47]。这两个国家的所有疫情都是由病毒改革引起的。在荷兰医院观察到的8起疫情中有3起,在德国医院观察到的6起疫情中有4起,报告了VREfm感染以及VREfm定植的患者[34,37,40,42,45,46,47]。在这些报告中观察到的一个共同因素是,殖民化在这两个国家的疫情发生中发挥了关键作用。
VRE流行病学综述
32项研究报告了住院患者中VRE的患病率或发病率:17项研究报告了VRE定植的患病率,3项研究报告了VRE在医院感染中的比例,11项研究报告了所有临床和筛查培养物中VRE的频率,1项研究报告了医院感染中VRE的比例以及临床和筛查培养物中VRE的频率。表1、表2和表3提供了详细的流行病学数据,说明所呈现的数字是与VRE分离株相对应,还是与诊断为VRE的患者总数相对应。
研究报告的preVRE co价lonization
在报告VRE殖民流行率的17项研究中,有3项来自荷兰医院,14项来自德国医院。一项队列研究和两项横断面研究调查了荷兰医院不同患者组的VRE定植情况(表1)。在队列研究中,三所大学医院的手术患者中耐万古霉素的粪便肠球菌定植率为1.1%[48]。在横断研究中,1991年在莱顿大学医院的血液学患者中进行的研究中,VRE定植(粪肠杆菌和粪肠杆菌)的患病率为12.9%[49],1995年至1998年在9家不同医院的重症监护和血液学肿瘤学患者中进行的研究中,VRE定植(粪肠杆菌和粪肠杆菌)的患病率为1.3%[50]。
在德国医院进行的9项横断面研究、2项队列研究和1项前后研究调查了不同患者组中VRE定植的流行情况。患病率在1.2%至27.7%之间(表2)[51、52、53、54、55、56、57、58、59、60、61、62]。所有研究都报道了VREfm定植的流行,除了三项研究,其中一项研究没有具体说明物种,另外两项研究同时报道了粪肠球菌和粪肠球菌[51,52,53,54,55,56,57,58,59,60,61,62]。研究显示,VREfm定植在血液肿瘤患者(23.8%)、老年患者(15.2%)和高危患者(27.7%)中的患病率最高[52,54,58,59]。两项全医院范围的研究报告了最低的VREfm定植率(1.2%和1.6%),其中不包括重症监护病房(ICU)患者[55,56]。其中一项研究在德国的六所大学医院进行,发现2014年至2018年住院患者中VREfm定植率增加(2014年为0.8%,2015年为1.2%,2016年为1.3%,2017年为1.5%,2018年为2.6%)[56]。
两项跨境研究比较了住院患者VRE定殖率(表3)。其中一项研究于2012年至2013年在荷德北部跨境地区的两所大学医院进行,德国医院的VRE定殖率(3.9%)是荷兰医院(1.3%)的3倍[63]。在2017年至2018年跨境地区23家医院的icu(8家荷兰医院和15家德国医院)进行的研究中,差异更为显著:德国医院的VRE定植率(2.7%)几乎是荷兰医院(0.1%)的30倍[64]。
报告VRE在医院感染中的比例和VREfm在血流感染(bsi)中的发生率的研究
报道医院性、侵入性VRE比例的研究均在德国医院进行,并显示近年来德国VRE感染呈上升趋势(表2)[65,66,67,68]。两项研究分析了来自德国国家医院监测系统(KISS, krankenhaus - infections -Surveillance-System, https://www.nrz-hygiene.de/kiss/kiss-module)的数据,并报告了VRE(粪肠杆菌和粪肠杆菌)在医院感染中的比例。第一项研究分析了2007 - 2012年icu和外科的VRE占院内感染的比例[67]。本研究发现,不仅VRE呈上升趋势(2007 - 2012年:SSI, 0.87% - 4.58%;BSI为4.91% ~ 12.99%;UTI患病率为2.23% - 6.19%),但联邦州之间也存在差异,包括德国中部的“VRE带”,从西部(北莱茵-威斯特伐利亚州)到东部(萨克森州)[67]。第二项研究描述了德国icu和外科病房中VRE引起的医院感染持续上升,从2007年的1.4%上升到2016年的10%[65]。
其余两项研究报告了血流感染(BSI)中VREfm的发生率密度。第一项研究是在德国北莱茵-威斯特伐利亚州31个实验室进行的前瞻性纵向研究[66]。本研究发现,VREfm BSI的发病率密度(每10万居民)从2016年的0.52增加到2019年的1.48[66]。第二项研究分析了ARS监测系统,该系统报告了全国VREfm BSI的估计发病率密度(每10万居民)从2015年的1.4增加到2020年的2.9[68]。
研究报告了所有临床和筛查培养中VRE的频率
所有12项研究(1项在荷兰医院进行,11项在德国医院进行)分析了微生物学数据,但没有区分VRE感染或VRE定植。除非另有说明,报告的数字代表了粪肠杆菌和粪肠杆菌分离株中VRE的总和比率。在荷兰格罗宁根大学医院(University hospital Groningen)进行的研究是一项横断面研究,报告ICU患者VRE患病率为0.3%[69]。
在德国的11项研究中,9项是横断面研究,1项是队列研究,1项是生态学研究(调查抗生素使用对VRE患病率的影响)。一项国际监测研究,包括2000年至2002年间169家德国医院的数据,报告了粪肠杆菌的VRE患病率为4.8%,粪肠杆菌为0.3%[70],一项分析2005年至2006年耐多药kiss数据的研究报告了ICU患者的VRE患病率为0.1%[71]。2012年在柏林大学医院进行的生态学研究报告VRE患病率为0.7% [72];2012年在慕尼黑37家急诊医院进行的一项点患病率研究显示,包括ICU患者在内的住院患者中VREfm的患病率为0.38%[73]。
其中三项横断面研究报告了近年来VRE发病率的增加。在德国不同地区(东部、北部、西南部、东南部)的四所大学医院进行的一项研究中,观察到2007年至2009年间VREfm的发病率有所增加(从每10,000名患者5例上升到9例,再上升到14例)[74]。两项研究分析了KISS和icu抗生素使用和耐药性监测(SARI)项目的数据,也记录了德国医院VRE的增加[67,75]。icu中VRE的发生率(每100名住院患者)从2007年的0.11例上升到2012年的0.31例[67],而另一项包括SARI队列的研究中,德国icu中VRE的耐药密度从2001年的0.1例上升到2015年的1.1例/ 1000患者日[75]。相比之下,2010年、2012年和2014年采用相同的研究方案,但参与医院数量不同的三项全国一日点患病率研究均未显示住院患者VRE定植或感染增加[76,77,78]。除了这些国家研究外,还进行了一项区域研究,以确定下萨克森州抗菌素耐药性的区域趋势。本研究对下萨克森州抗菌素耐药性监测(ARMIN)项目2006 - 2010年的数据进行了分析,引人注目的是,该研究报告了下萨克森州2006 - 2010年间VREfm病例比例从2006年的13.6%下降到2010年的5.6%[79]。
VRE随时间变化的分子流行病学
荷兰和德国医院的疫情数据显示,多年来VREfm引起疫情的分子流行病学已经从vanB为主转变为vanB为主(表1-2)[34,37,39,40,41,42,43,44,45,46,47]。
在荷兰,在报告的8次暴发中,有6次报告了分离株的vanA/B状态。1999年在阿姆斯特丹大学医院爆发的VREfm分离株均为钒病毒阳性[34],2012年至2014年在乌得勒支非大学医院爆发的另一次疫情中,大多数VREfm分离株均为钒病毒阳性[37]。相比之下,2014年和2017年在格罗宁根大学医院发生的两次疫情主要是由vanB-VREfm引起的[39,40]。同样,在2018年蒂尔堡某三级医院爆发的疫情中,所有VREfm分离株均为vanb阳性[41]。
在德国,所有报告的VREfm疫情都提供了分子数据。汉堡大学儿科医院(1993-1997年)、哈勒大学医院(1999-2001年)和
除上述疫情报告外,荷兰没有其他研究报告VRE的分子数据。然而,在德国的非疫情研究中也观察到,随着时间的推移,从vanA向vanB的转变(表2)。1995年在柏林两家医院进行的一项横断面研究[51]和2012年至2013年在科隆大学医院进行的另一项研究显示,大多数分离株都是vanA阳性[61]。相比之下,2013年之后的大多数研究都报道了vanB的优势,包括在德国南部一家三级医院进行的研究(2014-2015)[54],在科隆、弗莱堡、汉堡和
全国VRE监测数据报告最终水平
这两个国家都有自己的国家抗生素耐药性监测系统,包括VREfm,并且都将其结果提交给ear - net。
荷兰
来自荷兰医学微生物学实验室的所有分离株的微生物学数据均收集在传染病耐药性监测信息系统(ISIS-AR)中[80]。基于这些数据,并与荷兰医学微生物学会的荷兰抗生素政策工作组合作,自2003年以来每年发布一份SWAB/RIVM报告(NethMap)以监测AMR[81]。自2003年以来,有关临床分离株VRE的数据可在NethMap报告中获得(图3)。

2003年至2021年荷兰医院临床分离株中VREfm爆发次数(蓝框)和VREfm比例(橙框)摘要(NethMap报告)[81]。方框内的数据表示历年VRE数据的时间分布。(VREF:耐万古霉素E. faecalis, VREF:耐万古霉素E. faecium)
根据NethMap的报告,2008年至2011年间,医院中vanb阳性VREfm的比例显著增加(从0.1-0.8%增加到1.5%)。这一增长归因于病毒改革的爆发,特别是发生在该国北部地区的医院[81]。如图3所示,多年来荷兰报告了多次VREfm爆发。然而,在医院的粪肠杆菌临床分离株中,VREfm的比例保持在1%以下,并且在过去十年中没有变化。为了管理和预防医疗机构中AMR的大规模暴发,并在早期阶段控制其向其他机构的传播,2012年荷兰成立了医院感染和抗菌素耐药性早期预警和干预会议(SO-ZI/AMR)[82]。参与的医院自愿承诺遵守SO-ZI/AMR系统,其中包括报告义务和定期更新,直到疫情得到解决。在过去十年中爆发的所有病毒改革疫情中,2020年和2021年的记录数量最低。这种减少可能受到多种因素的影响,例如在COVID-19大流行期间实施了加强的感染控制措施,或者由于报告是自愿的,由于大流行的负担,报告可能减少。
荷兰目前没有对VRE的分子流行病学进行全国性监测。集中收集的全国VREfm分子分型数据仅在2012年至2018年期间可用,在此期间vanA总是比vanB更频繁[81]。
德国
所有来自德国参与医学微生物实验室和医院的分离株的微生物学数据收集在RKI自2008年以来建立的ARS数据库中[33]。2008年以前的国家数据可在所谓的《流行病学公报》中获得,该公报由RKI定期出版。根据这些报告,与前几年相比,2003年和2004年(包括筛查和临床样本)观察到的VREfm分离株数量有所增加[83]。在接下来的两年短暂减少之后,2007年数量再次增加[84]。自2008年以来,ARS数据库提供了有关从住院患者血液培养中获得的所有粪肠杆菌中VREfm比例(%)的数据(图4)。自2009年以来,可以观察到VREfm比例总体呈上升趋势。
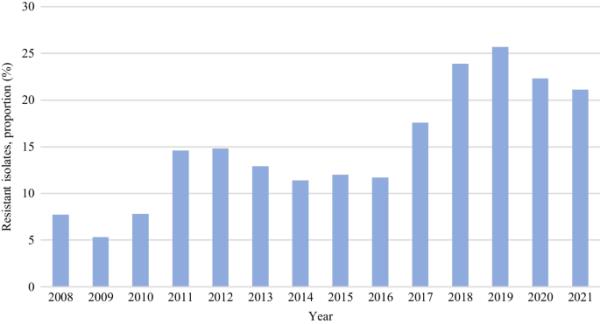
2008 - 2021年德国住院患者血培养中所有粪肠杆菌分离株中VREfm的比例(%)(ARS-RKI Statistics)[85]。(VREfm:万古霉素耐药大肠杆菌)
2012年RKI指定了葡萄球菌和肠球菌国家参考中心(NRC)[86]。根据NRC的数据,2017年首次发送到NRC的vanB-VREfm分离株明显多于vanA-VREfm分离株,此后情况一直保持不变[87,88]。
EARS-net
ear - net所代表的国家AMR数据分别来自荷兰的RIVM和德国的RKI[24]。2021年,荷兰ear - net监测数据的人口覆盖率为68%,德国为35%[89]。多年来,覆盖率保持相对稳定,荷兰的覆盖率始终高于德国[90]。在30个国家中,荷兰是数年来将临床粪肠杆菌分离株VRE率保持在5%以下的13个国家之一。相比之下,德国在2016年(11.9%)至2019年(26.3%)期间,这一比例持续上升,并从2017年开始超过欧洲平均水平(图5)[24]。有趣的是,2020年这一比例(22.3%)自2014年以来首次下降[91]。
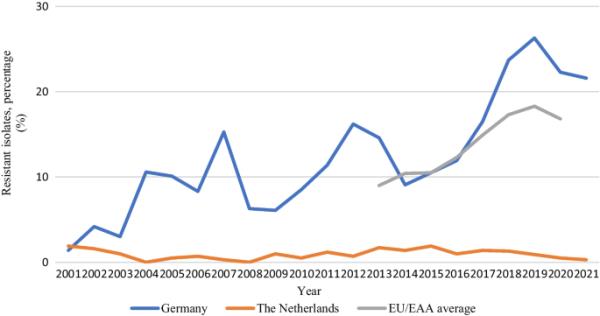
2001年至2021年期间荷兰和德国临床(侵袭性)粪肠杆菌分离株中VREfm的百分比。欧盟/EAA的平均水平仅在2013年至2020年期间报告。来自ECDC监测地图集的数据[92]
目录
摘要 背景 方法 结果 讨论 结论 数据和材料的可用性 缩写 参考文献 致谢 作者信息 道德声明 补充信息 搜索 导航 #####讨论
鉴于欧洲的治疗选择有限,VRE的流行率不断上升,VRE仍然是医疗保健中的一个严重问题[5,24]。尽管总体上有所增加,但据报道,各国之间存在较大差异[24]。据我们所知,我们通过回顾文献和国家监测数据,首次对荷兰和德国医院环境中的VRE流行病学进行了比较概述,涵盖了1.02亿欧盟居民。
在本综述中,两国的研究不仅在数量上存在差异,而且在设计类型上也存在差异。虽然荷兰的大多数研究都是疫情报告,但在德国,横断面流行率研究占主导地位。德国医院大量的横断面患病率研究可能表明,VRE在德国比在荷兰的医院是一个更相关的问题。
对疫情报告的分析显示,这两个国家的所有疫情都是由VREfm引起的。这并不奇怪,因为粪肠杆菌在医院环境中生存的韧性很高[93]。虽然感染率在国家内部和国家之间有所不同,但殖民化是这两个国家爆发病毒改革的共同原因。根据患者人群和时间的不同,VRE的患病率或发病率的研究差异很大。一般来说,两国的高危病房,如血液肿瘤病房和老年病房,均报告了较高的VRE患病率[49,52,53,54,59]。这一发现与先前的研究一致,即年龄和血液肿瘤恶性肿瘤是VRE定植和感染的危险因素[94,95,96]。
两国之间最显著的差异是,德国的研究显示,德国医院VRE患病率呈上升趋势,而荷兰的研究没有观察到这种趋势。必须承认,荷兰的研究数量较少,限制了就这一问题得出结论性意见的能力。跨界研究也表明,在对住院患者应用相同的筛查策略时存在这种差异[63,64]。这一观察结果得到了两国国家数据和ear - net数据的支持。ear - net数据显示,侵袭性感染患者临床分离的粪肠杆菌中VREfm的比例保持稳定,在过去十年中,荷兰的VREfm比例在1%以下略有波动,而在德国,VREfm比例已上升至25%以上,并呈上升趋势[24,65]。
在接下来的段落中,我们将阐述一些可能解释这两个邻国之间VRE流行病学差异的观点。
医疗保健系统
医疗结构的内在差异可以作为这种差异的主要解释[25,28]。德国和荷兰都有完善的医疗体系,然而,它们在重要方面有所不同[28]。首先,德国的住院治疗密度(病例数)、平均住院时间和床位占用率明显更高,这些因素都可能通过增加患者与患者和患者与医护人员(HCP)的接触而增加VRE传播的风险[28]。医院环境是VRE经表面传播的关键因素之一,医院的高入住率也会促进VRE的传播[16]。此外,高床位占用率导致用于隔离VRE患者的单间较少,这使得在德国医院实施适当的IPC规则具有挑战性[97]。相比之下,荷兰医院在入院时甚至会对高危患者实施先发制人的隔离[28,98]。其次,尽管住院人数较多,住院时间较长,但与荷兰医院相比,德国医院受到的hcp短缺的影响更大,导致人员不足,特别是在护理方面[28]。患者与医护人员之间的相互作用在VRE传播中起着至关重要的作用,这可能是德国医院中由于护士与患者的比例较低而导致VRE患病率较高的因素之一[99]。
感染有限公司控制指南
除了医疗结构的差异外,德国和荷兰的IPC国家医院预防VRE指南也存在差异[25]。医院mdro的频率可以作为IPC措施有效性的一个指标。在德国,医院卫生和感染预防委员会(KRINKO, Kommission fr Krankenhaushygiene und Infektionsprävention)和荷兰感染预防工作组(WIP, Werkgroep Infection prevente, Samenwerkingsverband richhtlijnen infectious prevente)发布了这些国家IPC指南[98,100,101]。总体而言,虽然德国指南中IPC规则的适用根据医院和地区的流行病学情况而有所不同,但荷兰指南中没有这种例外。KRINKO指南主要侧重于预防需要抗生素治疗的感染,并根据其发生VRE感染的风险对患者群体进行分类,而WIP指南则建议采用搜索和检测策略。例如,在WIP指南中,在VRE筛查中没有区分高风险病房和正常护理病房,而KRINKO指南建议仅对高风险病房的患者进行VRE筛查。两份指南对VRE携带者的管理也有所不同;WIP指南建议毫无例外地隔离接触者,但KRINKO指南将决定权留给临床医生,根据患者的风险评估。因此,荷兰医院采用更严格的感染控制规则可能有助于降低VRE的患病率。
抗生素消费
除了完善的IPC措施和对这些措施的遵守程度外,适当使用抗生素在预防VRE定植和感染方面也起着重要作用[102]。例如,广谱头孢菌素的使用通过促进VRE的获取和对胃肠道菌群施加高选择性压力,与VRE患病率增加有关[103,104,105,106]。1997年至2020年欧洲抗菌药物消费监测网络(ESAC-Net)的数据表明,德国社区中广谱头孢菌素的使用高于荷兰[107]。鉴于两国在使用这一特定抗生素组方面的差异,这可能也会对两国之间观察到的VRE患病率差异产生影响。
诊断
除了上述荷兰和德国之间概述的差异外,重要的是要考虑到诊断实验室方案、指南和检测VRE资源可用性的差异也可能影响各国报告的VRE病例[64]。诊断方案的差异,包括样本采集、培养技术和抗微生物药敏试验,都可能影响VRE的检测。例如,用于VRE分离的培养基和选择性试剂的差异会影响敏感性和特异性[108]。采用和实施监测指南的差异也会影响VRE的检测和报告,特别是在特定患者人群中VRE定植的筛查频率和程度[98,100]。此外,资源(财政、技术和人力)的可用性在实验室检测VRE的能力中起着重要作用,PCR检测等先进技术提高了灵敏度和速度[109]。这些因素可能影响VRE检测和报告的准确性和彻彻性,从而导致两国报告的VRE病例数存在差异。
共性
尽管在过去几十年中,荷兰和德国VRE流行病学的总体发展存在很大差异,但已经出现了两个共同趋势。第一个趋势是COVID-19大流行对VRE流行病学的潜在影响。ear - net 2020年和2021年报告的数据表明,与前一年相比,这两个国家的VRE暴发次数和临床分离的所有粪肠杆菌中VRE的比例都有所下降[110]。这种下降可能是由于医疗保健专业人员对IPC措施的认识提高,以及COVID-19大流行导致医疗服务中断。然而,也有可能是医院对抗菌素耐药性监测的不重视和对国家监测系统的参与较少导致了对实际情况的低估。
第二个趋势是VRE的分子流行病学随时间的变化。在德国,已对提交给NRC的所有肠球菌进行了分子分型分析,而在荷兰,此类分析仅适用于2012年至2018年期间集中收集的肠球菌。除了国家监测数据外,已确定的出版物表明,自2014年以来,在荷兰和德国,vanB开始被报道为主要聚集性[39,40,41,54,56,59]。分子流行病学的这一转变引发了争论,即这种变化是由于vanB菌株的实际传播增加还是实验室中vanB- vre检测的局限性造成的[111]。比较研究表明,常规实验室常用的梯度试药法和自动抗生素药敏试验方法无法检测vanb介导的万古霉素耐药[112,113]。EUCAST也承认了这些问题,并修订了建议,以减少检测vanB-VRE的错误率[114]。
限制
本研究存在局限性。首先,由于研究设计、患者群体、时间框架和结果定义的异质性,不可能进行荟萃分析。其次,由于参与的医院和实验室数量的变化以及两国不同的数据收集合规情况,比较国家监测数据可能会产生偏差。第三,在医院层面对国家IPC指南的实施和遵守情况进行全面比较超出了本研究的范围,因此我们无法比较医院实践的真实记录。
下载原文档:https://link.springer.com/content/pdf/10.1186/s13756-023-01278-0.pdf

